
4.下列各组离子中,在给定条件下能大量共存的是 ( )
A.在滴加石蕊试液显红色的溶液中:Fe2+、K+、NO3-、Cl-
B.在pH为1的溶液中:Cu2+、Na+、Mg2+、NO3-
C.在pH为13的溶液中:K+、HCO3-、Br-、Ba2+
D.在常温时由水电离产生的c(H+)=1.0×10-13mol·L-1的溶液中:
Na+、NH4+、HCO3-、SO42-
3.下列表述中,不正确的是 ( )
A.熵值增大的过程不一定都能自发进行
B.用酸式滴定管量取0.100 0 mol·L-1的KMnO4溶液20.00 mL
C.铁在电化腐蚀的过程中有电流产生
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量相同
2.设NA表示阿伏加德罗常数,下列有关说法中正确的是 ( )
A.0.1 mol H3O+中含有的电子数为NA
B.由2H和18O所组成的水11 g,其中所含的中子数为4NA
C.1 L 0.5 mol·L-1CH3COONa溶液中含有的CH3COO-个数为0.5 NA
D.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子
1.目前全球掀起新一轮探月高潮。月球上蕴藏着丰富的氦-3(3He),用它可以来代替铀等辐射性较大的元素进行核聚变来发电。关于3He的下列说法中,正确的是 ( )
A.3He原子与3H原子中含有相同的中子数
B.3He的核聚变属于化学反应
C.3He单质中的分子为单原子分子
D.3He与4He互为同素异形体
29.(15分)已知:A是一种药品,A~K均是芳香族化合物, F不与溴水反应。根据下图所示的转化关系,回答问题:
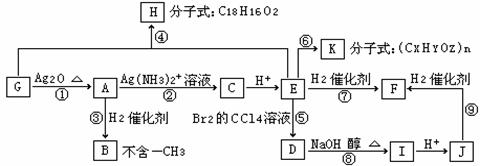
⑴写出下列物质的结构简式:
B , F 。
⑵写出下列反应的化学方程式:
① 。
④ 。
⑧ 。
⑶上图所示的转化关系中,属于消去反应的是 ,属于聚合反应的是 ,有机物发生氧化反应的是 。(以上各空用序号填写)
(4)含有苯环、只有一个侧链且属于酯类F的同分异构体有________种。
28.(13分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
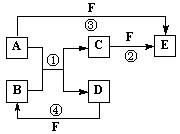
(1) 若A、D、F都是短周期的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则B的名称是______________,所属晶体类型为_________________。
(2) 若A是常见的可变价金属单质,B是强电解质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________________________。
已知1 g D与足量的F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式_______ _____________________________________。
(3) 若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体产生,则B的结构式为______________,F为______________(填名称)的浓溶液。
27.(20分)请按要求填空:
Ⅰ.下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用稀HNO3清洗做过银镜反应实验的试管;
②在中学《硫 酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次;
酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次;
③用碱式滴定管量取20.00 mL 0.1000 mol·L-1 KMnO4溶液;
④除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧除去CO中少量O2:通过灼热的Cu网后收集气体;
⑨除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤;
Ⅱ.某实验小组用废铁屑或废铁丝与稀硫酸在加热条件下制取FeSO4·XH2O,并测定该晶体中结晶水含量。
(1)铁屑表面少量的铁锈(主要成分为Fe2O3·AH2O)对制取硫酸亚铁有无影响?其原因是什么?
(2)FeSO4在不同温度下的溶解度如下表所示
温度/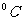 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度/g |
18.5 |
20.8 |
26.3 |
32.8 |
40.1 |
48.4 |
52.4 |
50.9 |
43.7 |
由于废铁屑含有C、S等杂质,为了使FeSO4溶液的浓度增大,便于反应后分离溶液和残渣,拟采用水浴加热和趁热过滤的方法。实验时,水浴温度最好控制在 ℃左右。
(3)测定晶体中结晶水含量所用的实验仪器除托盘天平、研钵、坩埚钳、三脚架、酒精灯、药匙外,还有 ;判断晶体中的结晶水完全失去的实验操作是 。
(4)计算FeSO4晶体化学式中X的表达式为X= (已知FeSO4晶体的质量为wg,FeSO4晶体中结晶水的质量为mg)
(5)由于铁屑或铁丝与硫酸反应速率慢,实验过程中有人提出采用电解的方法,可以加快制取FeSO4溶液的反应速率,该方法的电解质溶液是 ,阳极的电极反应式为 。
26.(12分)有A、B、C三种元素,其原子序数之和是26,A元素的+1价离子A+核外有10个电子,B元素原子核外L层电子数是K层电子数的2倍。请回答:
(1)A的元素符号是________,B的元素名称是__________;
(2)A+的结构示意图是__________,B和C形成的最简单化合物分子的电子式是____________;
(3)用电子式表示A和C形成化合物的过程___________________________________;
(4)写出A的单质在足量O2中燃烧的产物与B的最高价氧化物反应的化学方程式________ _____________________,生成1mol氧化产物转移电子的物质的量是______。
13.经测定,某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法中错误的是( )
A.溶液中四种离子之间有可能满足:c(Cl-)> c(H+)> c(NH4+)> c(OH-)
B.若溶液中离子间满足:c(Cl-)> c(NH4+)> c (H+)> c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中离子间满足:c(NH4+)> c(Cl-)> c(OH-)> c(H+),则溶液中溶质一定为NH4Cl和NH3·H2O
D.若溶液c(Cl-)= c(NH4+),则该溶液一定显中性
第Ⅱ卷(非选择题,共174分)
12.在给定条件下,下列加版权所有点的物质在化学反应中能被完全消耗的是
A.用30 mL 12 mol/L的浓盐酸与10 g MnO2共热制氯气
B.标准状况下,将1 g铝片投入20 mL 18 mol/L的浓硫酸中
C.在5×107 Pa、500℃和铁触媒催化的条件下,用过量的氮气和氢气合成氨
D.向100 mL 3 mol/L的硝酸溶液中加入5.6 g铁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com