
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是 ( )
A.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如下图所示,其化学式为C3H6N6
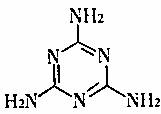
D.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识。
22.(共5分)甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)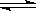 CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容器密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH2OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。试回答:
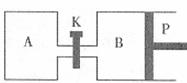
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”、“<”、“=”) A。
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
21.(共9分)某链烃A的分子式为C6H12,已知其分子中所有的碳原子共平面,该分子的一氯取代物只有一种,回答下列问题:
(1)A的结构简式为 ;下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等的是(填序号) 。
a. C7H12O2 b. C6H12 c. C6H12O d. C7H14O3
(2)A与Br的CCl4溶液反应生成B,B与NaOH的醉溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学反应方程式: 。
(3)B与足量NaOH水溶液完全反应,生成有机物E。
①E可能发生的反应类型有(填序号)
a. 取代反应 b. 消去反应 c. 加聚反应 d. 还原反应
②E与乙二醇的关系是(填序号)
a. 同分异构体 b. 同一物质 c. 同系物 d. 同素异形体
(4)E与乙二酸在一定条件下生成分子式为C8H12O4的有机物,请写出该反应的化学方程式 。
(5)已知: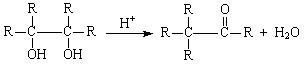 (-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子相同,能发生银镜反应,且结构中有两个甲基的异构体共有 种。
(-R为烃基),请写出E在酸性条件下生成G的化学反应方程式:
。与G分子相同,能发生银镜反应,且结构中有两个甲基的异构体共有 种。
20.(共11分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
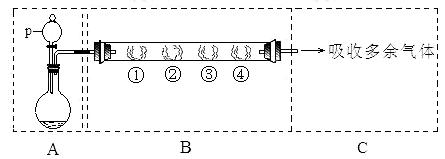
请回答下列问题:
I.(1)仪器p的名称是 ,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
(2)写出③中反应的离子方程式: 。
II.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。
(1)仪器p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
。
①处包有的某固体物质可能是(填序号) 。
a. MnO2 b. KMnO4 c. KCl d. Cu
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
。
19.(共8分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
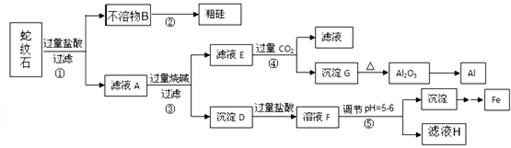
有关氢氧化物沉淀的pH见下表:
|
金属阳离子 |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Mg2+ |
9.4 |
11.6 |
请回答下列问题:
(1)滤液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 ,
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号) 。
a. NaOH溶液 b. 氨水 c. MgO d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
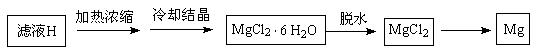
流程中由MgCl2冶炼Mg的方法是 。在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是 。
18.(共9分)有关元素X、Y、Z、D、E的信息如下
|
元素 |
有关信息 |
|
X |
元素主要化合价为-2,原子半径为0.074nm |
|
Y |
所在主族序数与所在周期序数之差为4 |
|
Z |
原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
|
D |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
|
E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变成紫色
(3)用化学符号表示D2Z的水溶液中各粒子的浓度关系,如c(Z2-)= 。
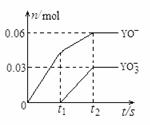
(4)将一定量的Y单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是 ,该反应中转移电子的物质的量是 。
17.(共7分)甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如下图所示。
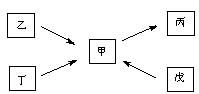
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14。写出由甲生成戊的化学方程式 ,欲检验乙中官能团,所选用的试剂为(填序号) 。
①NaOH溶液 ②Br2的CCl4溶液 ③银氨溶液 ④AgNO3溶液 ⑤稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 ,戊的稀溶液能跟过量铁粉反应,其离子方程式为 。
(3)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在一定条件下可生成戊。甲与戊两种溶液混合能生成沉淀丙,其离子方程式为 ,若镁粉中混有少量的丁,除去丁的离子方程式为 。
16.(共6分)请根据工业制硫酸的有关知识回答下列问题:
(1)黄铁矿在沸腾炉中反应的化学方程式为
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见下图)。按此密闭体系中气体的流向,则在R处流出的气体中除N2外的主要组成为(填序号)
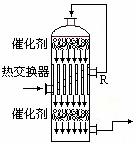
A.SO2 B.SO2、SO4 C.SO2、O2 D.SO3、O2、SO2
(3)接触法制硫酸过程中: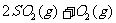
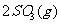 根据下表中的数据判断下列图像正确的是(填序号)
根据下表中的数据判断下列图像正确的是(填序号)
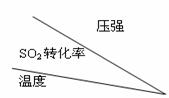 |
P1 |
P2 |
|
400℃ |
99.6 |
99.7 |
|
500℃ |
96.9 |
97.8 |
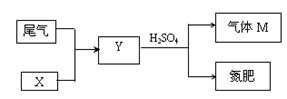
(4)下图是工业制硫酸的尾气的综合利用,气体M回收后可进入接触室循环生产,请根据图示判断X是(填名称) ,写出Y与硫酸反应生成M的化学方程式: 。
15.有9.7gCu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为22.4L。将溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3-的浓度为( )
A.0.3mol/L B.0.4mol/L C.0.5mol/L D.0.6mol/L
第Ⅱ卷(非选择题,共55分)
14.某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极板收集到气体总体积为22.4mL时,剩余溶液恢复至原温度,析出溶质mg;若两极收集到气体总体积为33.6mL时,剩余溶液恢复至原温度,析出溶质ng。则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积) ( )
A.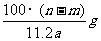 B.
B.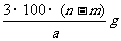
C.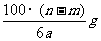 D.
D.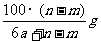
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com