
21.(8分)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:

回答下列问题:
(1)小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
(2)小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(3)小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的PH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
(常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
①Al(OH)3开始析出时溶液的pH为
②若溶液中离子的浓度约为1.0×10-5 mol·L-1时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出? ,理由
20.(10分)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。
|
(1)写出氢气完全燃烧生成液态水的热化学方程式
(2)若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ(填>、=、<)
(3)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为 (取简单整数比,下同);燃烧生成的CO2的质量比约为
(4)以上数据和计算说明,以天然气代替水煤气作用燃料,突出的优点是
18.(8分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。实验室常用过氧化氢分解来制取氧气,但过氧化氢在通常情况下分解缓慢,因此实际操作中需要使用催化剂。
(1)下图是甲同学就二氧化锰和氧化铁分别对过氧化氢分解催化能力的比较而设计的实验装置。(注:仪器A中的压强可通过压强传感器再与压强采集器相连,可连续测出不同时间点仪器A中的压强值)其主要实验步骤
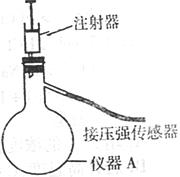
如下:
第一步:按图示将装置连接好;
第二步: ;
第三步:在仪器A中加入少量MnO2,在注射器中加入约5.0mL5%的H2O2溶液;
第四步:接通采集器电源,设置每隔1s测量一次仪器A中的压强,测定点数为70点;
第五步:向仪器A中注入2.0mL H2O2溶液并保持注射器活塞不移动,同时开始测定仪器A中的压强。再选择氧化铁代替二氧化锰重复上述操作。
回答下列问题:
①保存过氧化氢试剂瓶上最适合贴上的一个标签是 (填序号);
②仪器A的名称是 ;
③上述第二步实验步骤是 ;
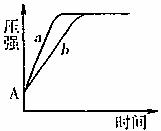
④下图是氧化铁和二氧化锰分别催化分解过氧化氢时体系压强的变化曲线(a线表示二氧化锰,b线表示氧化铁),则A点数据的含义是 ,二氧化锰对过氧化氢分解的催化能力比氧化铁 ,判断依据是 。
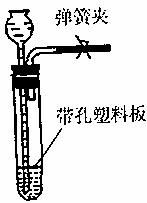
(2)下图是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。乙同学经过认真研究,将二氧化锰粉末与水泥按一定比例制成块状固体后终于创造性地解决了上述问题。你认为他这样做的优点有① ,② 。
17.常温下,KSP(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是 ( )
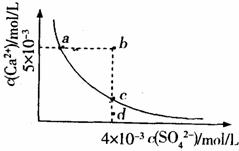
A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO2-4)对应曲线上任意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol
C.d点溶液通过蒸发可以变到c点
D.a点对应的KSP等于c点对应的Ksp
第Ⅱ卷(非选择题部分,共49分)
16.在密闭容器中,有可逆反应:nA(g)+mB(g)  pC(g)处于平衡状态(已知m+n>p,△H>0)下列说法中正确的是 ( )
pC(g)处于平衡状态(已知m+n>p,△H>0)下列说法中正确的是 ( )
①升高温度时,c(B)/c(C)的值减小;②降温时,体系内混合气体的平均摩尔质量减小;③充入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A、B的物质的量增大
A.③④ B.②③⑤ C.①②⑤ D.全部
15.元素A的单质及A与B形成的化合物能按如下图所示的关系发生转化。则下列说正确的是 ( )
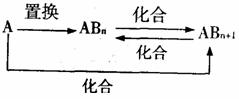
A.当n=1时,A可能是N2
B.当n=2时,A可能是Fe或Al
C.A一定是金属元素
D.图中物质间的转化都是氧化还原反应
14.下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;
④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.由水电离和c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
13.可逆反应A(g)+B C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是 ( )
C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是 ( )
A.增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
B.若升高温度,C的百分含量减少,则说明正反应为放热反应
C.若增大压强,平衡不移动,则说明B和D一定都是气体
D.如果B是气体,则增大A的浓度会使B的转化率增大
12.下列说法正确的是 ( )
A.pH=3的HX酸与pH=11的YOH碱等体积混合,所得溶液的pH一定为7
B.在0.1mol/L (NH4)2Fe(SO4)2溶液中
c(H+)+c(NH+4)+c(Fe2+)=c(OH-)+c(SO2-4)
C.在醋酸钠溶液中加入适量醋酸,所得酸性溶液中
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.2mol/L HCl与0.1mol/L NaAlO2等体积混合,所得溶液中
c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com