
27.(9分)X、Y、Z、W、N五种短周期主族元素的原子序数为X>W>Z>Y>N,W原子的最外层电子数是X原子最外层电子数的一半,Y是形成化合物种数最多的元素,Z原子次外层电子数是最外层电子数的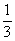 ,N元素原子半径是所有原子中最小的,这五种元素原子核电荷数总和为38。
,N元素原子半径是所有原子中最小的,这五种元素原子核电荷数总和为38。
(1)X________,Z_______(填元素符号)。
(2)这五种元素原子半径的大小为:__________>_______>_______>_______>_______(填元素符号)。
(3)W、X元素的最高价氧化物对应水化物的碱性强弱为______<______。(用化学式表示)
(4)写出由上述元素组成的具有漂白作用的三种物质的化学式_______、_______、_______。
(5)写出由Y、Z、W、N四种元素成的化合物溶于水,并与水反应的化学方程式_______________________________________________________。
26.(6分)位于元素周期表第三、四两周期中的主族元素A和B,它们的离子相差两个电子层。已知A元素位于元素周期表中第m主族,B元素位于第n主族。那么:
(1)A元素原子的核外电子数为_______(用含m的代数式表示),其离子最外层电 子数为_______;
(2)B元素原子的核内质子数为_______(用含n的代数式表示),其离子的电子数为_______;
(3)A、B两元素形成的化合物的化学式为AB2,其化学键类型为_______;
(4)用电子式表示AB2为_______。
25.在相同状况下将镁、铝、铁分别投入质量相等且足量的稀硫酸中,反应结束后,三种溶液的质量仍相等,则投入镁、铝、铁三种金属的质量关系正确的是 ( )
A.Mg > Al > Fe B.Al > Fe > Mg C.Al > Mg > Fe D.Fe > Mg > Al
24.臭氧可使湿润的KI淀粉试纸变蓝,反应式:2KI+O3+H2O==2KOH+I2+O2,下列说法正确的是 ( )
A.O3在反应中被氧化成O2
B.O2氧化能力大于O3
C.1molO3反应中得到2mol电子
D.氧化产物O2与还原产物I2的物质的量之比为1∶1
23.A、B、C、D是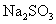 、
、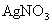 、HCl、
、HCl、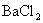 四种无色溶液中的某一种,把它们两两混合产生的现象是:A+B→白色沉淀;A+C→白色沉淀;B+C→白色沉淀;C+D→白色沉淀;B+D→无色、有刺激性气味的气体.则上述四种物质按A、B、C、D的顺序是( )
四种无色溶液中的某一种,把它们两两混合产生的现象是:A+B→白色沉淀;A+C→白色沉淀;B+C→白色沉淀;C+D→白色沉淀;B+D→无色、有刺激性气味的气体.则上述四种物质按A、B、C、D的顺序是( )
A.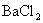 、
、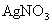 、
、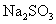 、HCl B.
、HCl B.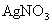 、HCl、
、HCl、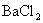 、
、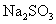
C.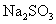 、HCl、
、HCl、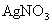 、
、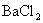 D.
D.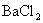 、
、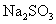 、
、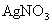 、HCl
、HCl
22.下列离子方程式正确的是 ( )
A.氯气通入水中:Cl2 + H2O == 2H++Cl-+ClO-
B.向偏铝酸钠溶液中通入过量的CO2气体:AlO2―+ 2H2O+CO2 == Al(OH)3+HCO3―
C.加热浓盐酸和二氧化锰的混合物:MnO2+4H++4Cl- Mn2++2H2O+2Cl2↑
Mn2++2H2O+2Cl2↑
D.向澄清的石灰水中加入少量NaHCO3:
Ca2++2OH―+2HCO3―==CaCO3↓+2H2O+CO32―
21.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应生成H2S2。H2S2类似于H2O2,易分解:H2S2=H2S+S↓实验室用稀盐酸制H2S时,某学生误将FeS2颗粒当作FeS作用,当FeS2反应完后,不可能生成的物质是 ( )
A.H2S B.S C.FeS D.FeCl2
20.用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是 ( )
A.所消耗的硝酸的量:①>②>③
B.对环境造成的危害,③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量相等
19.A、B、C三种元素是短周期元素,其原子序数依次递增,核电荷数总和为25,且A与B两元素能形成AB、AB2两种常见的共价化合物,以下选项不正确的是 ( )
A.原子半径C>B>A B.三种元素形成的化合物是离子化合物
C.A的单质有多种同素异形体 D.C与B能形成两种化合物C2B和C2B2
18.下列四种短周期元素中,其单质氧化性最强的是 ( )
A.元素周期表中第三周期ⅢA族元素
B.原子最外层电子数比次外层电子数多5的元素
C.原子M层电子数比L层电子数少1的元素
D.原子最外层为第n层,最外层有2n2个电子的元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com