
2.下列说法正确的是 ( )
A.在有机物分子中,含有的氢原子个数一定是偶数
B.分子组成相差若干个CH2的有机物互为同系物
C.所有糖类物质都有甜味
D.油脂是食物中产生能量最高的营养物质
1.下列叙述正确的是 ( )
A.北京奥运会“鸟巢”使用了11万吨钢,钢的强度要比纯铁的强度弱
B.我国发射神州七号载人飞船运载火箭的推进剂引燃后,产生大量的高温红色气体从尾部喷出,这主要是NO2气体
C.北京奥运会奖牌“金镶玉”使用的材料都是金属材料
D.北京奥运会水立方是世界上规模最大的膜结构工程,该建筑和围护结构采用了一种新型的乙烯-四氟乙烯共聚物材料。此共聚物为天然高分子化合物。
29.(18分)
(1)某温度时,水的KW=10-13,则该温度 (填“大于”、“小于”或“等于”)25℃,其理由是 。将此温度下pH=11的NaOH溶液a升与pH=1的H2SO4的溶液b升混合,若所得混合液为中性,则a:b= 。
(2)25℃时,用0.2mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合,测得混合后溶液pH=10,则混合溶液中:c(HA) c(A-)(填“<、>、=”);c(HA)+c(A-)=
mol·L-1;由水电离出的c(OH-)与pH=10NaOH溶液中由水电离出的c(OH-)的比值为 。
(3)25℃时,如果取上述0.2mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合,测得混合后溶液的pH<7,则下列有关离子浓度判断正确的是 ( )
①c(A-)+c(HA)=0.2mol/L ②c(H+)+c(Na+)=c(A-)+c(OH-)
③c(A-)+c(Na+)>c(H+)>c(OH-) ④c(Na+)>c(A-)>c(H+)>c(OH-)
(4)中和体积为Va的上述0.2mol·L-1HA溶液,恰好消耗0.2mol·L-1NaOH溶液的体积Vb,则Va Vb(填“<、>、=”下同),若使混合后溶液恰好呈中性,则 Va Vb。
28.(17分)某课外小组设计了如下图所示的实验装置,进行气体性质实验。
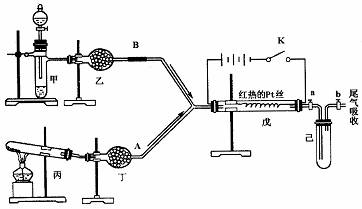
图中箭头表示气体流向,A、B分别表示两种纯净、干燥的气体。反应进行一段时间后,装置乙中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O、蒸馏水。
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为__________ ____
(2)丁中的干燥剂应选 ________。
(3)甲中发生反应的化学方程式为___________ _________
(4)戊中发生的主要反应的化学方程式为___________,此反应是吸热反应,可以证明你的判断的现象是 。
(5)当乙中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞。取下乙装置并浸入冰水中则乙中会出现的现象是 ,简述产生此现象的原因 。
27.(6分)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g) 2HI(g);△H<0,并达到平衡。HI的体积分数φ(HI)随时间变化如图曲线(II)所示:
2HI(g);△H<0,并达到平衡。HI的体积分数φ(HI)随时间变化如图曲线(II)所示:
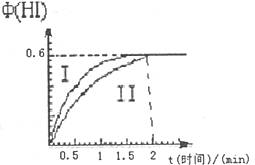
(1)平衡时,I2(g)的物质的量浓度为_________
(2)若改变反应条件,在某条件下φ(HI)的变化如曲线(I)所示,则乙条件可以是________(填入下列条件的序号)
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入amol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的关系式是___ (用一个含a、b、c的代数式表示)。
26.(19分)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自最高价氧化物对应的水化物可以反应生盐和水,该反应离子方程式为
。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
> > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式: 。
13.下列离子方程式书写正确的是 ( )
A.次氯酸钙溶液中通入足量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.Ca(HCO3)2溶液中滴加少量NaOH Ca2++2HCO-3+2OH-=CaSO3↓+CO2-3+2H2O
C.泡沫灭火器的原理 Al3++3HCO-3=Al(OH)3↓+3CO2↑
D.AlCl3溶液中加入过量氨水 Al3++4NH3·H2O=AlO-2+4NH+4+2H2O
第Ⅱ卷
12.下列实验问题处理方法正确的是 ( )
①用pH试纸测溶液pH时,将试纸用水润湿再蘸取待测液
②实验中,点燃CO前应首先检验CO的纯度
③实验室的白磷保存在CS2中
④给试管中的液体加热时加入碎瓷片,以免暴沸伤人
⑤测定硫酸铜结晶水含量时,将晶体加热至白色,然后冷却称重即可计算
⑥配制稀硫酸时,先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
A.①② B.②④⑤ C.①③⑤ D.②④⑥
11.混合下列各组物质,加热蒸干并在300℃灼烧至质量不变,最终残留固体为纯净物的是
( )
A.等物质的量的Al2(SO4)3与AlCl3溶液
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在Na2SO3溶液中充入一定量氯气
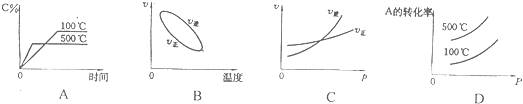
10.用来表示可逆反应:2A(g)+B(g)  2C(g)(正反应放热)的正确图象是下图中的( )
2C(g)(正反应放热)的正确图象是下图中的( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com