
25.(1)下列有关化学实验的基本操作中,正确的是
A.配制500mL某物质的量浓度的溶液,可用两个250mL的容量瓶
B.用渗析分离淀粉溶液中的氯化钠杂质
C.测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;
D.用酸式滴定管量取20.00mL高锰酸钾溶液
E.测定某溶液的pH,将干燥的度纸浊浸入到特测溶液,过一会儿取出,与标准比色卡比较
F.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体
G.配制硫酸亚铁溶液时,先将硫酸亚铁溶在少量浓盐酸中,再加水稀释,并加少量铁粉
H.在氢氧化铁胶体中加少量硫酸,会产生沉淀
I.测晶体中结晶水含量时,必须将加热后的固体在空气中充分冷却后才能进行称量
(2)三氯化铁是中学化学实验室中常用的化学试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
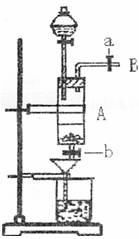
(1)收集导管B处的气体可采用的方法是 。滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
(2)烧杯内放过量稀HNO3的原因是 ,发生反应的离子方程式是 。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是 。
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是 。
24.已知A-K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:
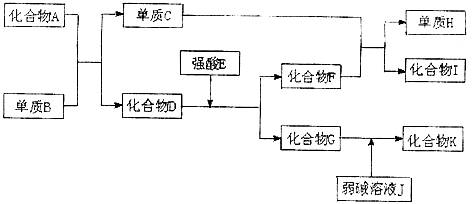
请回答:
(1)写出有关物质化学式:D是 ,B是 。
(2)写出下列反应的方程式:
①化合物G的溶液不呈中性,其原因可用离子方程式 表示,
②C+F →H+I 。
23.合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+H2(g) 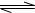 2NH3(g);△H=-92.4kJ/mol请回答:
2NH3(g);△H=-92.4kJ/mol请回答:
(1)合成氨对工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触媒加快化学反应速率
b.采用较高压强(20M Pa-50M Pa)
c.将原料气中的少量CO等气体净化出来
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 molN2和3molH2并发生反应。
①若容器容积恒定,达到平衡时,气体的压强为原来的7/8,则N2的转化率α1= ,此时反应放出的热量 kJ;
②若容器压强恒定,则达到平衡时,容器中N2的转化率=α2 α1(填“<”“>”或“=”)
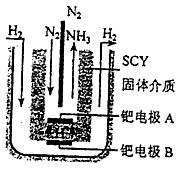
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合所氨(装置如下图)。钯电极A是电解池的 极(填“阳”或“阴”)该极上的电极反应式是 。
22.X、Y、Z、W均为短周期非金属主族元素,原子序数依次增大。Z的质子数等于X、Y质子数之和;W与Z最外层电子数相同,且W的电子总数是Z的电子总数的二倍。
(1)Y单质的结构式: 其氢化物的空间结构呈 形。
(2)X、Z元素可组成原子个数比为1:1的化合物甲,其电子式为 Z、W元素可组成质量比为1:1的化合物乙,甲与乙反应生成一种常见强酸丙,化学方程式为: ;用惰性电极电解丙溶液的阳极反应式 。
(3)Y的氢化物与化合物乙有许多性质相似。结合下图回答:
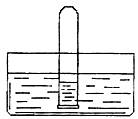
如何通过它们溶于水时的现象不同来鉴别它们:
。
(4)由X、Y、Z、W四种元素可组成多种离子化合物,其中有一种,溶于水时完全电离产生三种离子,且溶液呈酸性,0.1mol/L该盐溶液中,离子浓度由小到大的顺序是: 。
21.某无色混合气体中可能含有NH3、O2、H2、NO、HCl等,将它通过浓H2SO4后,气体体积减少,将剩余气体与空气接触后呈红棕色。此混合气体中一定含有 ,一定不含 ,可能含有 。(填化学式)
20.在一定条件下,相同pH的硫酸和硫酸铝溶液中水电离出的c(H+)分别为1.0×10-amol/L和1.0×10-bmol/L,在此温度下,水的离子积Kw为 ( )
A.1.0×10-14 B.1.0×10-2a C.1.0×10-(7+a) D.1.0×10-(a+b)
第Ⅱ卷(共50分)
19.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
C.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
D.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
18.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a。将其全部投入50mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是 ( )
|
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
17.下列各组溶液,只能用其它试剂才可以将它们区分开的是 ( )
A.KOH、K2CO3、MgSO4、KHSO4 B.Cu(NO3)2、HCl、NH4Cl、KOH
C.BaCl2、CaCl2、Na2SO4、AgNO3 D.H2SO4、Al2(SO4)3、NaCl、KOH
16.下图所示的三个容积相同的容器中进行如下的反应:
3A(g)+B(g) 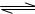 2C(g)(正反应放热)若起始温度相同,分别向三个容器中充入3molA和1molB,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 ( )
2C(g)(正反应放热)若起始温度相同,分别向三个容器中充入3molA和1molB,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 ( )
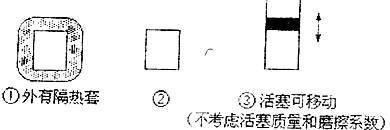
A.①②③ B.③②① C.②①③ D.③①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com