
29.(18分)某有机物A只含C、H、O三种元素,可用作染料、医药的中间体,具有抗菌、祛痰、平喘作用。A的蒸气密度为相同状况下氢气密度的77倍,有机物A中氧的质量分数约为41.6%,请结合下列信息回答相关问题。
①A可与NaHCO3溶液作用,产生无色气体;
②1 molA与足量金属钠反应生成H233.6 L(标准状况);
③A可与FeCl3溶液发生显色反应;
④A分子苯环上有三个取代基,其中相同的取代基相邻,不同的取代基不相邻。
请回答:
(1)A的分子式是 ;A中含氧官能团的名称是 。
(2)写出A与NaHCO3溶液反应的化学方程式: 。
(3)已知:
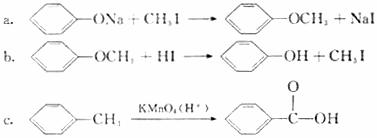
有机物B的分子式为C7H8O2,在一定条件下发生如下转化,最终生成A;
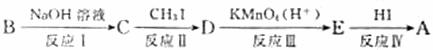
请回答:
①反应Ⅱ的化学方程式是 。
②上述转化中,反应I、Ⅱ两步的作用是 。
③B可发生的反应有 (填字母)。
a取代反应 b.加成反应 c.消去反应 d.水解反应
(4)芳香族化合物F与A互为同分异构体,可发生银镜反应,1 molF恰好与含3 molNaOH的溶液作用,其苯环上的一卤代物只有一种。写出F的一种可能的结构简式 。
28.(14)现将水蒸汽和CO气体分别通入到体积为1L的恒容密闭容器中进行反应。H2O(g)+CO(g) CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO2 |
|||
|
1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
0.8 mol |
5 min |
|
2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.2 mol |
3 min |
|
3 |
900℃ |
a mol |
b mol |
c mol |
d mol |
t |
(1)由以上数据,实验1中以v(CO2)表示的反应速率为 mol/(L·min)。
(2)比较该反应实验1和实验2中CO的转化率:a1 a2;该反应的反应热△H 0。(两空填“>”、“=”或“<”)
(3)若实验3要达到与实验2等效的平衡状态,且t<3 min,则a、b应满足的关系是 。
(4)900℃时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可采取的措施有(填字母) 。
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D.缩小容器体积
27.(14分)某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分泥污,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
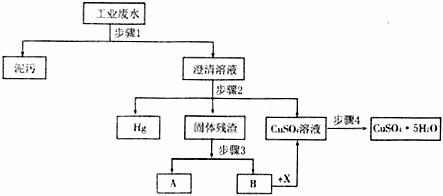
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外还有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) 。
(3)步骤2中在分离Hg和固体残渣时,采用在封闭体系中加热、冷凝回收的方法,原因是 。
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜和水,反应方程式是 。
(5)步骤4中涉及的操作是:蒸发浓缩、 、过滤、烘干。
26.(14分)有四种短周期元素Y、M、Z、X,其原子序数依次增大,其微粒结构或性质特点如下表:
|
元素编号 |
元素微粒结构或性质特点 |
|
X |
标准状况下X2的密度为3.17g/L |
|
Y |
原子最外层电子数为此外层电子数的2倍 |
|
Z |
最高价氧化物E是通讯材料光导纤维的主要原料 |
|
M |
0.1mol/L M的最高价氧化物的水化物N的水溶液pH=13 |
(1)M离子的离子结构示意图为: ;
(2)Y形成一种可用作装饰品的单质,其晶体的熔点与Z单质比较,熔点较高的是 (填化学式),Z最高价氧化物晶体类型是 。
(3)写出N与X2单质反应的离子方程式: 。
(4)以石墨和铁作电极,用电解槽电解化合物MX的水溶液,阳极产生X2,铁应作 极,若该电极逸出1.12 L(标准状况)气体,则电路中转移电子 mol。
13.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合前后的体积变化)
|
|
① |
② |
③ |
④ |
|
pH |
12 |
12 |
2 |
2 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和③加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl一)>c(NH4+)>c(OH一)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
非选择题
12.下图是778K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
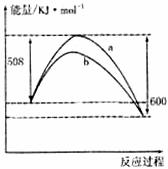
A.此反应N2+3H2 2NH3为吸热反应
2NH3为吸热反应
B.加入催化剂,该化学反应的△H变大
C.b曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,逆反应速率不变
11.下图中,两电极上发生电极反应。a极:Cu2++2e一===Cu,b极:Fe一2e一===Fe2+,下列说法不正确的是
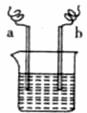
A.装置中电解质溶液一定含有Cu2+
B.该装置一定是化学能转化为电能
C.a极上一定发生还原反应
D.a、b可能是同种电极材料
10.下列做法存在安全隐患的是
①将水沿着烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌;
②实验室制取氯气结束时,先撤水中的导管后撤酒精灯;
③取用金属Na或K时,剩余的药品要放回原瓶;
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏的原因,并打开所有的门窗通风;
⑤干冰是干粉灭火器的常见成分,可用作镁、铝等金属的灭火;
⑥做苯酚性质实验时,因为常温时苯酚在水中的溶解度较小,所以可以将废液直接排入下水道。
A.①④⑤⑥ B.①②③④ C.①③④⑤ D.全部
9.下列说法正确的是
A.二氧化碳分子内存在非极性共价键和分子间作用力
B.甲烷、氨和水都是由极性键结合而成的极性分子
C.同主族不同元素的最高价氧化物,一定具有相同的晶体结构
D.氟化氢的沸点高于氯化氢,正丁烷的沸点高于异丁烷
8.设NA为阿伏加德罗常数,下列有关叙述不正确的是
A.常温常压下,l mol甲基(一CH3)所含的电子数为10NA
B.0.4 mol任意比混合的乙炔和乙醛气体充分燃烧,消耗氧气分子数为NA
C.常温常压下,NA个甲烷分子的体积大于22.4 L
D.0.1 mol Na2O2与足量的水反应,转移的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com