
7.一定能在下列溶液中大量存在的离子组是 ( )
A.PH=1的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的C(H+)=1×10-13mol·L-1的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.PH=14的溶液:Na+、K+、AlO2-、CO32-
6.下列生活中的化学小实验不合理的是 ( )
A.用米汤检验加碘盐中的碘酸钾(KIO3)
B.用食用醋除去热水瓶中积存的水垢
C.用纯碱(Na2CO3)溶液洗涤沾有油污的器具
D.用灼烧并闻气味的方法区分化纤织物与纯毛织物
29.(17分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是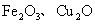 或二者混合物。探究过程如下:
或二者混合物。探究过程如下:
查阅资料:
Cu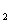 O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO
O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO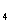 。
。
提出假设:
假设1:红色粉末是Fe 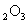
假设2:红色粉末是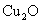
假设3:红色粉末是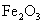 和
和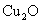 的混合物
的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若假设1成立,则实验现象是_________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是_________,写出溶液中发生相关反应的离子方程式_________ 。
探究延伸:
经实验分析,确定红色粉末为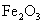 和
和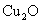 的混合物。
的混合物。
(3)实验小组欲测定Cu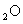 的质量分数。已知
的质量分数。已知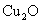 在空气中加热生成CuO。请你设计一个简单的实验方案,描述相关的实验过程,用相关的字母如a、b、……来表示按流程先后次序所测相关数据的大小,并写出混合物中
在空气中加热生成CuO。请你设计一个简单的实验方案,描述相关的实验过程,用相关的字母如a、b、……来表示按流程先后次序所测相关数据的大小,并写出混合物中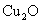 的质量分数的表达式。_________
的质量分数的表达式。_________
(4)实验小组欲利用该红色粉末制取较纯净的胆矾(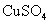
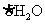 )。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使
)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使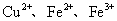 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:

实验室有下列试剂可供选择:A.氯水 B.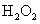 C.
C.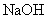 D.
D.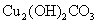 。
。
实验小组设计如下实验方案制取胆矾:
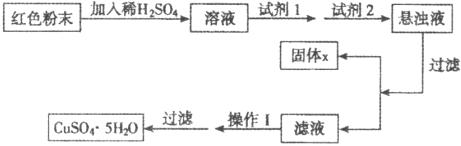
试回答:①用试剂编号表示:试剂l为________,试剂2为________ 。
②固体X的化学式为________ 。
③操作I ________。
28.(17分)某化合物X的分子式为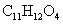 ,它有如下转变:
,它有如下转变:
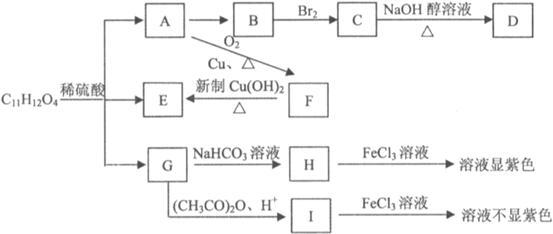
其中,A→B为消去反应,D分子中所有原子共直线。I是一种为人们所熟知的具有镇痛、退热等功效的药物。
请回答下列问题:
(1)D的结构式为_________,H的分子式为_________ 。
(2)写出E的同分异构体中所有能与银氨溶液反应的物质的结构简式_________ 。
(3)写出A→B的反应的化学方程式_________ 。
(4)G中所含含氧官能团的名称为_________。
(5)已知I中苯环上含有二个相邻的基团,写出生成I反应的化学方程式_________。
(6)Y为X的同分异构体,且已知Y的水解产物中含有甲醇和乙醇,请写出Y的一种可能的结构简式_________ 。
27.(12分)取一张用饱和的NaCl溶液浸湿的石蕊试纸,平铺在一块金属板上,按如下图所示的方法连接电路。
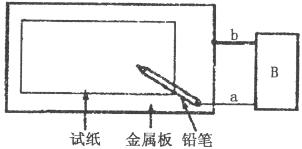
(1)如果金属板为铂片,B处为直流电源,接通电源后:
①若试纸为红色石蕊试纸,用铅笔在试纸上写字,出现蓝色字迹。则a电极为电源的_________ (填“正极”或“负极”),铅笔芯与试纸接触的电极反应为_________。
②若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,接触处出现一个双 色同心圆,内圈为白色,外圈呈浅红色。则a电极为电源的_________ (填“正极”或“负极”),铅笔芯与试纸接触处的电极反应为_________ 。
(2)如果试纸为红色石蕊试纸,金属板为锌片,B处为灵敏电流计,接通电路,将铅笔芯放置在试纸上一段时间,发现电流计指针发生偏转,则接触处将_________ (填“变白”、“变蓝”或“不变色”),铅笔芯与试纸接触处的电极反应为_________。
26.(12分)已知A、B、E是常见的非金属单质,其中A为淡黄色固体,Y是常见的金属单质,C的相对分子质量比A大32,D、G均是重要的工业产品,Y、F、H、I均含有同种元素。X含有两种元素,具有摇篮形的分子结构,球棍模型如图所示。H为红褐色沉淀。图中部分反应条件和产物已略去。
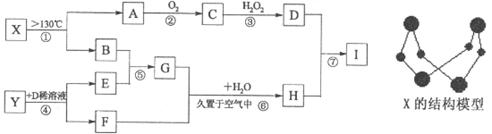
试回答下列问题
(1)写出X的化学式:____________ 。
(2)写出G的电子式:____________。
(3)写出反应③的化学方程式:____________。
(4)写出C和I溶液反应生成F的离子方程式:____________。
13.在恒温恒容条件下有下列反应:
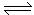
 。现分别从两条途径建立平衡:(I)A和B的起始浓度均为
。现分别从两条途径建立平衡:(I)A和B的起始浓度均为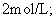 (Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
(Ⅱ)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
A.I和II两途径最终达到平衡时,体系内各气体的体积分数分别相同
B.达到平衡时,I途径混合气体密度为II途径混合气体密度的2倍
C.I和II两途径最终达到平衡时,体系内各气体的物质的量分别相同
D.达到平衡时,I途径的反应速率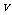 (A)等于II途径的反应速率
(A)等于II途径的反应速率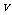 (B)
(B)
第Ⅱ卷(非选择题共174分)
12.化学反应: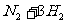
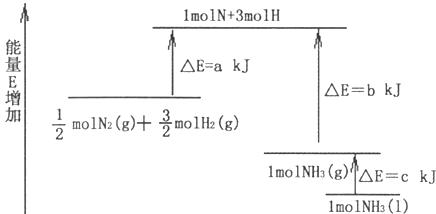
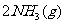 的能量变化如下图所示,该反应的热化学方程式是
的能量变化如下图所示,该反应的热化学方程式是
A.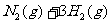
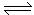
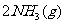
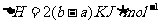
B.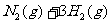
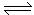
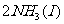

C.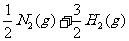
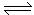
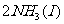

D.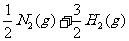
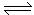
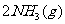
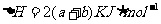
11.经测定某种溶液中只含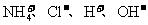 四种离子,下列说法错误的是
四种离子,下列说法错误的是
A.溶液中四种离子之间可能满足: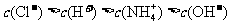
B.若满足: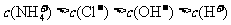 ,则溶质一定是
,则溶质一定是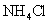 和
和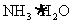
C.若满足: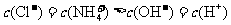
D.若满足: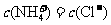 ,则溶液一定呈中性
,则溶液一定呈中性
10.化学平衡常数(K)、电离常数(K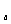 )、溶度积常数(K
)、溶度积常数(K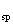 )是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.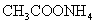 溶液几乎呈中性,说明
溶液几乎呈中性,说明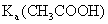 与
与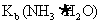 近似相等
近似相等
C.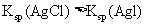 由此可以判断
由此可以判断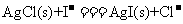 能够发生
能够发生
D.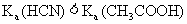 说明相同浓度时,氢氰酸的酸性比醋酸强
说明相同浓度时,氢氰酸的酸性比醋酸强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com