
2.2 关于Ca(HCO3)2沉淀的探讨
“问题”一文中指出:“‘NaHCO3与CaCl2、BaCl2等不反应’,这也是教师不去查证的结果,由于碳酸氢钙和碳酸氢钡能溶于水,但溶解度并不是很大,所以当二者的浓度稍大,就会明显地看到白色沉淀。”
NaHCO3与CaCl2、BaCl2反应的确能得到白色浑浊,究竟是不是Ca(HCO3)2和Ba(HCO3)2,我认为需要考证。“问题”一文中称“溶解度并不是很大”,我翻遍《兰氏化学手册》和《化学数据速查手册》[9]竟然找不到碱土金属的碳酸氢盐的踪影,更不用说它们的物理性质和热力学参数了。可见,迄今为止尚未有人从水溶液中分离出Ca(HCO3)2和Ba(HCO3)2等碱土金属的碳酸氢盐,但是几乎所有的化学教材却都承认Ca(HCO3)2和Ba(HCO3)2的存在,如大学无机化学教材中就有这样的描述:“碱土金属的硝酸盐、氯酸盐、高氯酸盐、醋酸盐、酸式碳酸盐、酸式草酸盐、磷酸二氢盐易溶”[10]。我认为,我们与其信其无,不如信其有,这正像我们还没有分离出H2CO3,但仍然相信有这种物质的存在。如果这种沉淀是Ca(HCO3)2和Ba(HCO3)2,那么我们得到Ca(HCO3)2和Ba(HCO3)2应该是很容易的事情,按理也就可以获得它们的物理性质的数据,但这又与上述手册中的具体表现是有出入的。
因此,我认为这种沉淀最有可能是CaCO3(或BaCO3)。因为在NaHCO3溶液中存在以下三个化学平衡:
H2O H++OH-,HCO3-
H++OH-,HCO3- H++CO32-,HCO3-+H2O
H++CO32-,HCO3-+H2O H2CO3+OH-。
H2CO3+OH-。
已知25℃时,0.1mol·L-1的NaHCO3溶液的pH值为8.3,H2CO3的电离常数K1=4.3×10-7,K2=5.61×10-11[11],CaCO3的溶度积常熟Ksp=4.96×10-9[12]。因此有:
c(H+)=10-8.3mol·L-1,c(OH-)=10-6.7mol·L-1。
设c(HCO3-)=x mol·L-1,c(CO32-)=y mol·L-1,c(H2CO3)=z mol·L-1,则有:
c(HCO3-)+c(CO32-)+c(H2CO3)=x+y+z=0.1,
c(H+)·c(CO32-)/c(HCO3-)= 10-8.3×y/x=K2=5.61×10-11,
c(H2CO3)·c(OH-)/c(HCO3-)=z×10-6.7/x=Kw/K1=10-14/(4.3×10-7)。由此可以得到:
x=c(HCO3-)=8.86×10-2mol·L-1,y=c(CO32-)=9.92×10-4mol·L-1,z=c(H2CO3)=1.04×10-2mol·L-1。
假设在3mL 0.1mol·L-1的NaHCO3溶液中滴入1滴(以1/20 mL计)0.1mol·L-1的CaCl2溶液,则有:
c(Ca2+)= [0.1mol·L-1 ×(1/20)mL]/3mL=1.67×10-3mol·L-1,
c(Ca2+)·c(CO32-)=1.67×10-3a×9.92×10-4=1.66×10-7>>Ksp= 4.96×10-9。
从计算的角度看,向0.1 mol·L-1的NaHCO3溶液中滴加1滴0.1mol·L-1的CaCl2就能产生CaCO3沉淀。
2.1 关于原子半径的探讨
“问题”一文中指出:“‘在进行原子或离子半径大小比较时,电子层数越多半径越大’。只要查一下有关半径的数据,就会发现一般IA和IIA的原子半径都比其下一周期的VIA、VIIA的原子半径大,显然电子层数越多半径越大的结论有点想当然。”
“电子层数越多半径越大”这个命题本身有致命的弱点我们暂且不论,但我认为,这一命题至少在一定条件下是成立的。考虑问题是需要条件的,没有条件,命题要么就是真理,放之四海皆受用,要么就是没有任何用处。命题如果没有条件,或许更有断章取义的嫌疑。
如果给上述命题加上合理的条件也未尝不可,如“一般情况下,电子层数越多半径越大”,显然,这些描述对于教师来说意义不大,但是对于学生来说并不是没有意义的,至少能让他们认识到这样一种规律的存在,但又不是确凿无疑的,还有继续考证的必要。如教材中的描述:“碱金属元素的原子,其最外电子层上都只有1个电子,随着核电荷数的增多,它们的电子层数逐渐增多,原子半径逐渐增大”[5],这一结论同样可以推广到其他各主族元素的原子半径比较。
此外,原子半径的标度很多,各种不同标度的原子半径显然不同,甚至差别可能很大。通常书籍上记载的原子半径往往是通过测定结构的实验方法进行计算而得到的,但是它同样仍有三种基本形式:一是“共价半径”,由共价分子或原子晶体中原子的核间距计算而得;二是“范德华半径”,由共价分子之间的最短距离计算而得;三是“金属半径”,由金属晶体中原子的最短核间距计算而得。一般说来,共价半径较小,金属半径居中,范德华半径最大[6]。原高中化学教材中也曾以脚注的方式指出:“稀有气体元素的原子半径测定与相邻非金属元素的依据不同,数字不具有可比性,故不列出。”[7]这一表述中其实也隐含了金属原子与非金属原子半径的测定方式也不尽相同。如在国际上享有盛誉的《兰氏化学手册》[8]中所载的原子半径绝大多数是金属的原子半径,氢、氮、氧、氯、溴、碳、砷、碘等非金属元素则没有列出原子半径,而它们的半径则列在共价半径栏目中。显然,把3种不同概念的原子半径混为一谈是毫无意义的。换言之,比较不同原子的相对大小,取用的数据来源必须一致。
29.(14分) 自然地理环境各要素通过水循环、大气循环、生物循环和岩石圈物质循环等过程,进行着物质迁移和能量交换,形成了一个相互渗透、相互制约和相互联系的整体。读图十四,回答相关问题。
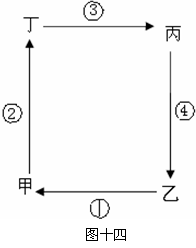 ⑴ 若此图表示地壳物质循环模式,②表示外力作用,则图中表示岩浆的是 (填文字),④表示 作用。(2分)
⑴ 若此图表示地壳物质循环模式,②表示外力作用,则图中表示岩浆的是 (填文字),④表示 作用。(2分)
⑵ 若此图表示城市热岛效应,则图中甲为 (选填“城市”或“乡村”)。为改善城市大气质量,①处适宜布局 。(2分)
⑶ 若此图表示海陆间水循环,则图中乙处为 ,人类对图中环节影响最大的是 (填序号),改变其时空分布的有效措施是 、 。(4分)
⑷ 若此图表示北半球低纬度大气环流圈,则图中①的风向是 ;乙处的气压带是 ,甲处的降水类型是 。(3分)
⑸ 若此图表示季风环流,乙为亚洲大陆东部,则图中反映的季节是 (1分),江苏地区 灾害严重。(2分)

 蚌埠二中2010届高三10月份月考
蚌埠二中2010届高三10月份月考
28.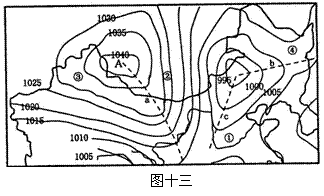 (12分)读“我国部分地区某时地面天气形势图”(图十三),回答下列问题。
(12分)读“我国部分地区某时地面天气形势图”(图十三),回答下列问题。
⑴ 此时A处于 气压控制下,天气状况是 。
⑵ 图中虚线(a、b、c)附近易形成暖锋的是 , c系统过境后的天气是
(2分)
⑶ 图中①②③④地中,风速最大的是 ,判断的理由是 。
⑷ 根据上面的天气形势图作出的天气预报正确的是(单选)
A.东北地区有阴雨天气 B.塔里木盆地吹西北风
C.内蒙古高原东部为晴朗天气 D.华北平原盛行东北风
⑸ 如果该天气形势出现在春季,那么我国西北、华北地区有可能出现
和 等灾害性天气。
27.读“两地区等高线分布示意图”,以及流经两地区主要河流流域的“气温曲线和降水柱状图”“径流季节分配和补给类型图”,回答有关问题。(14分)
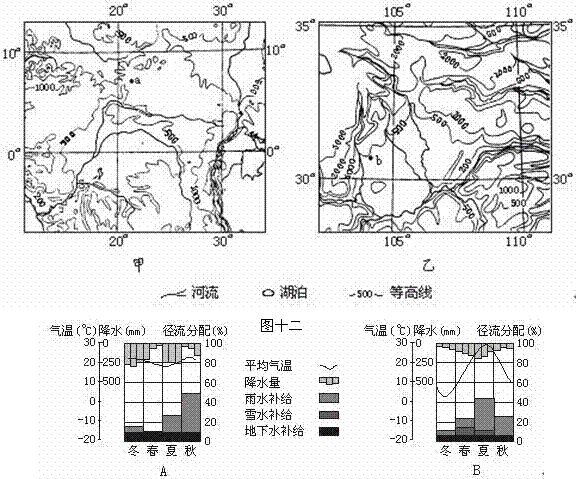
(1)甲、乙两图所示地区地形有哪些相似之处?请简要说出判断依据。
(2)对照A、B两图,甲图所示地区水能丰富的原因是 、 。
(3)乙图所示地区的西侧是 (地形区),它对其北边地区的气候影响是 。
(4)甲、乙两图中,地震灾害较频繁的是______图。并分析其形成原因。
26.(10分)读下列图表材料回答问题。
材料一 26-29届夏季奥运会举办地和举办时间
|
届数 |
26 |
27 |
28 |
29 |
|
举办地 |
亚特兰大 |
悉尼 |
雅典 |
北京 |
|
举办时间 |
1996年7月19日至8月4月 |
2000年9月15日至10月1日 |
2004年8月 13日至29日 |
2008年8月 8日至24日 |
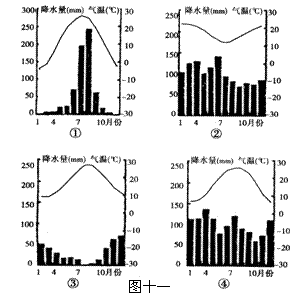 材料二 26-29届夏季奥运会举办地城市的气候资料统计图
材料二 26-29届夏季奥运会举办地城市的气候资料统计图
(1)判断材料二中②、④两城市的名称:________________________。(2分)
(2)比较①、③两城市气候特征的主要差异。_____________________。(3分)
(3)26-29届夏季奥运会期间,露天赛场日均温最低的是哪一届奥运会?并说明判断理由。__________________。(5分)
25、根据河流沉积物的变化,推断该城被遗弃的原因可能是
A地壳运动剧烈 B.瘟疫流行
C.水源不足 D.水土流失
24、该河流量、流速最小的时期是
A.Ⅰ时期 B.Ⅱ时期 C.Ⅲ时期 D.Ⅳ时期
读某区域部分地理信息图,回答22-23题。

22、甲区域气候一年分干、湿两季,据图判断其形成的主要因素是
A.纬度位置 B.地势 C.大气环流 D.洋流
23、乙海域有一大范围渔场,若用洋流剖面示意图来解释其成因,应选

图示(图十)为“我国西北古城遗址附近的古河床剖面图”, 沉积颗粒由大到小依次是Ⅱ、Ⅲ、Ⅳ、Ⅰ,读图完成24-25题。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com