
5.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是 ( )
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A.① B.①③ C.①②④ D.①⑤
4.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是 ( )
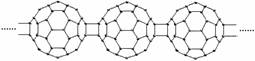
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
3.干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
|
物质 |
干燥效率 |
物质 |
干燥效率 |
|
MgO |
0.008 |
ZnCl2 |
0.8 |
|
CaO |
0.2 |
ZnBr2 |
1.1 |
分析以上数据,下列有关叙述错误的是 ( )
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
2.下图是制取和收集某气体的实验装置,该装置可用于 ( )
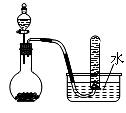
A.用浓盐酸和二氧化锰反应制取Cl2 B.用过氧化钠固体和水反应制取O2
C.用浓硝酸与铜反应制取NO2 D.用浓氨水和生石灰反应制取NH3
1.C、N、S元素都是生命体的重要组成元素,它们在自然界的平衡已受到较大的破坏。C、N、S元素在地球大气圈、岩石圈、水系、生物圈的循环过程中会产生的物质是( )
①HNO3 ②CO2 ③糖类 ④CH4
A.② B.②③ C.②③④ D.①②③④
33.(4分)如下图所示,向甲中充入1.5molA、3.5molB,关闭阀门K,向乙中充入3molA、7molB,开始时,甲和乙体积都为V升,在相同温度和有催化剂存在的条件下,两个容器中各位发生下列反应: 3A(g)+2B(g)  C(g)+2D(g);△H<0达到平衡(Ⅰ)时,V(乙)=0.86VL,请回答:
C(g)+2D(g);△H<0达到平衡(Ⅰ)时,V(乙)=0.86VL,请回答:
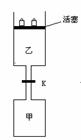
(1)乙中B的转化率为_______________
(2)甲中D和乙中C的物质的量比较____________ (填写:相等、前者大、后者大)
32.(14分)下图是短周期元素形成的单质和化合物之间的相互转换关系图,其中B是一种氧化物,C是一种有色气体,试回答以下问题
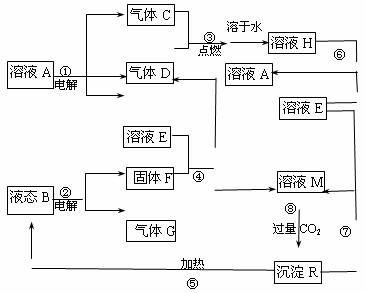
请回答下列问题:
(1)用化学式表示:B________ E________
(2)①到⑧步反应中属于氧化还原反应的是________________________________
(3)写出构成气体C、D、G的三种元素按照原子个数比为1:1:1形成的化合物的电子式_______
(4)写出下列反应的离子方程式:
①__________________________________________________________
④__________________________________________________________
⑧__________________________________________________________
(5)当反应①和反应②中转移电子数相等时,生成气体D和G的物质的量比为_________
31.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B、C、E、F的最高价氧化物对应的水化物中酸性最强的是 (填化学式)
(2)A、B、E、H最高价氧化物的熔点由高到低排列的是________________(填化学式)
(3)请比较G、H、E、F四种元素所形成的简单离子半径大小(由大到小排列)___ _____
(4)EBC-和A2D2在碱性条件下反应生成了ED42-和可参加大气循环的两种无毒无害气体及水,试写出该反应的离子方程式 。
30.(6分)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
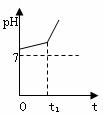
① 在0→t1时间内,两个电极上的电极反应式为:
阳极 ;
阴极 。
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:
。
29.(4分)回答下列问题:
(1)保持恒温,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(2)以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为__________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com