
5.相同质量的下列物质被人体消化后产生的热量最多的是
A.淀粉 B.油脂 C.蛋白质 D.维生素
4.当大气中碳氢化合物和二氧化氮共存时,在紫外线作用下容易形成的危害是
A.酸雨 B.温室效应 C.臭氧空洞 D.光化学烟雾
3.下列食品或饮料应尽量少吃的是
A.豆浆 B.大蒜 C.腌制类食品 D.有机蔬菜
2.目前,许多城市都对生活垃圾进行分类,其中宜制成燃油和燃气的垃圾是
A.废塑料 B.废电池 C.废纸 D.废食品
1.目前,我国重点城市空气质量日报的监测项目不包括
A.SO2 B.CO2 C.NO2 D.总悬浮颗粒物
23.(8分)如下图所示,有A、B两只密闭容器,A容器有一个移动的活塞,能使容器内保持恒压,B容器能保持恒容。起始时A、B两容器的容积均为1L,分别将2molSO2、lmolO2充入A容器中,4molSO2、2molO2充入B容器中。在保持400℃的条件下,发生反应2SO2(g)+O2(g) 2SO3(g),平衡时A容器的容积为0.8L。
2SO3(g),平衡时A容器的容积为0.8L。
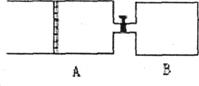
请回答:
(1)A容器中SO2的转化率为_______________。
(2)A、B两容器中SO2的转化率是A________B。(填“大于”、“小于”或“等于”)
(3)当A、B两容器连接后,打开开关使互通一段时间后,又重新达到新平衡时,A容器的体积为___________L(设连通管中气体体积不变)。
(4)若开始时B充入2molSO2、1molO2,则连通A和B后,A容器的容积为__________L。
22.(10分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
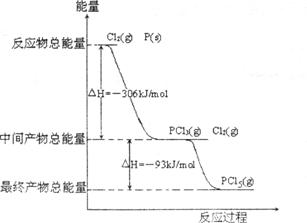
根据上图回答下列问题:
②PCl5分解成PCl3和Cl2的热化学方程式________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率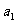 等于_________;若反应温度由Tl升高到T2,平衡时PCl5的分解率为
等于_________;若反应温度由Tl升高到T2,平衡时PCl5的分解率为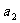 ,
,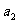 ________
________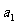 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
②P和Cl2分两步反应生成lmolPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4_________△H3(填“大于”、“小于”或“等于”)。
21.(8分)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。“嫦娥一号”使用的推进剂是液氢和液氧。298K时,氢气燃烧的热学化方程式为:
H2(g)+1/2O2(g)==H2O(1) △H=-285.8kJ/mol
①己知:H2(g)=H2(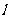 ); △H=-0.92 kJ/mol
); △H=-0.92 kJ/mol
O2(g)=O2(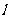 ); △H=-6.84kJ/mol
); △H=-6.84kJ/mol
H2O( )=H2O(g); △H=+44.0kJ/mol
)=H2O(g); △H=+44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:________________________________。
②氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:
负极_____________________________;正极_______________________________;
总反应式________________________________________。
20.(8分)在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的体积恒定的密闭容器中,立刻出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2(g)的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
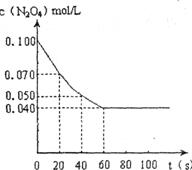
(1)计算在20至40秒时间内,NO2的平均生成速率为_________mol.L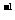 ·S
·S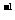 。
。
(2)该反应的化学平衡常数表达式为K=_____________。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
|
T/K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是______________反应(选填“吸热”或“放热”)。
(4)能判断该反应已经达到化学平衡状态的依据是___________________________。
A.容器内的压强保持不变 B.气体的密度保持不变
C.N2O4的浓度保持不变 D.气体的颜色不再变化
19.(10分)(1)若反应aA(g)+bB(g) cC(g)+dD(g),在体积不变的密闭容器中达到化学平衡以后,升高温度或增大压强会使平衡混合物中C的质量分数降低,那么:
cC(g)+dD(g),在体积不变的密闭容器中达到化学平衡以后,升高温度或增大压强会使平衡混合物中C的质量分数降低,那么:
①正反应是____________反应(填“放热”或“吸热”)
②反应物与生成物之间化学计量数之间的关系(a+b)________(c+d)(填“>”、“<”或“=”)
③为了提高A的转化率,可以采取下列哪些措施_________________。
A.增加B的浓度. B.及时分离产物. C.增加A的浓度
D.降低温度. E.减小容器体积 F.充入惰性气体
(2)在500℃、1.01×105Pa和使用催化剂的条件下,在1个容积可变的密闭容器中,充入2mol SO2和1molO2,经一段时间后得到含SO3的体积分数为91%、SO2的体积分数6%的混合气,此时混合气中各气体的浓度不再变化。
①在500℃、1.01×105Pa下,若向该混合气中充入l mol O2,则达平衡后混合气中SO2的体积分数__________6%(填“>”、“=”或“<”,下同);
②在500℃、1.01×105Pa下,若向该混合气中充入l molN2,则达平衡后混合气中SO3的体积分数为_______91%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com