
24.常温下,一元酸HA溶液和一元碱BOH溶液等体积混合,所得溶液呈酸性,有关判断正确的是:
A.若混合前酸、碱pH之和等于14,则HA一定是弱酸
B.若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱
C.溶液中水的电离程度:混合溶液>纯水>BOH溶液
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
23.S(单斜)和S(正交)是硫的两种同素异形体。已知:
①S(单斜,s)+O2(g)==SO2(g)△H1=-297.16kJ·mol-1
②S(正交,s)+O2(g)==SO2(g)△H2=-296.83kJ·mol-1
③S(单斜,s)==S(正交,s)△H3下列说法正确的是:
A.△H3=0.33kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)==S(正交,s)△H3<0,正交硫比单斜硫稳定
D.S(单斜,s)==S(正交,s)△H3>0,单斜硫比正交硫稳
22.下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是:
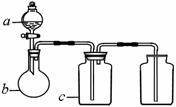
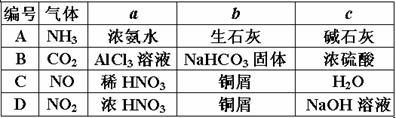
21.下列叙述正确的是:
①CO2的大量排放会加剧温室效应
②正常雨水的pH 为5.6,主要是因为溶解了SO2
③利用太阳能、风能和氢能替代化石能源能改善空气质量
④含磷合成洗涤剂易于被细菌分解,不会导致水体污染
⑤为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤
20.化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),以下结论不正确的是:
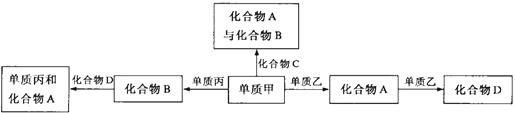
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体一定是分子晶体
D.上图所示的五个转化关系中,均为氧化还原反应
19.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是:
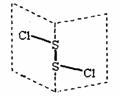
A.S2Cl2的电子式为
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
18.根据相关化学原理,下列推断正确的是:
A.若弱酸HA 的酸强于弱酸HB ,则同浓度钠盐溶液的pH : NaA < NaB
B.若X3+ 离子的质子数为a ,中子数为b ,则X 的质量数为:a + b + 3
C.若ⅡA族X元素的原子序数为m ,则同周期ⅢA族Y元素的原子序数可能为m +25
D.若M3+ 离子的最外层电子数为2,在周期表中M可能位于ⅡA
17.下列有关热化学方程式的叙述中,正确的是:
A.含20.0 g NaOH 的稀溶液与稀盐酸完全中和,放出28.7 kg的热量,则表示该反应中和热的热化学方程式为:HCl(aq)+NaOH(aq)= H2O(aq)+ NaCl(aq);ΔH=-57.4 kJ· mol-1
B.由4P(s,红磷)= P4(s,白磷);ΔH >0可知,白磷的热稳定性比红磷大
C.已知2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ·mol-1 ,则H2 的燃烧热大于241.8 kJ·mol-1
D.已知:2C(g)+ 2O2(g)=2CO2(g);△H1 及:2C(s)+ O2(g)=2CO(g);△H2 ,则△H1 <△H2
16.下列说法不正确的是:
A.将NH4HCO3 和NaOH 的混合物灼烧,得到的固体可能只有Na2CO3
B.pH=12 的烧碱和氢氧化钡溶液,二者物质的量浓度之比为2:1
C.2CaSO4·H2O的摩尔质量为290g
D.CH3COOH、CH3COONa浓度均为0.1 mol·L-1 的混合溶液的PH<7,则
c(CH3COO- )>c(CH3COOH)
15.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.
已知反应: Fe2O3 +
3Na2O2 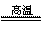 2Na2FeO4 + Na2O
下列说法正确的是:
2Na2FeO4 + Na2O
下列说法正确的是:
A.Na2O2既是氧化剂又是还原剂
B.在Na2FeO4中Fe 为+6 价,具有强氧化性,能消毒杀菌
C.3 mol Na2O2发生反应,有12 mol 电子转移
D.Na2FeO4既是氧化产物又是还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com