
5.化学反应经常伴随着颜色变化,下列有关反应的颜色变化不正确的是 ( )
A.苯酚遇FeC13溶液--紫色 B.溴化银见光分解--白色
C.新制氯水久置后--无色 D.苯酚在空气中氧化--粉红色
4.下列药品保存方法正确的是 ( )
A.白磷保存在煤油中 B.在氯化亚铁试剂中加盐酸和铁粉
C.金属钾保存在CCl4中 D.过氧化钠保存配有玻璃塞的广口试剂瓶中
3.下列叙述正确的是 ( )
A.光导纤维的成分属硅酸盐
B.NCl3的电子式为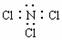
C.Cl原子的结构示意图为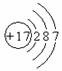
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
2.下列各组物质都是纯净物的是 ( )
A.液氨、液溴、氯水 B.汽油、甘油、油脂
C.冰、干冰、冰醋酸 D.纯盐酸、重水、酒精
1.氧气是生命活动中不可缺少的物质之一,而臭氧却是一种有刺激性气味的气体,浓度较高时会对人体健康造成危害,氧气和臭氧应属于 ( )
A.同系物 B.同素异形体 C.同位素 D.同分异构体
28.(14分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是 。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进 。
27.(12分)2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)写出(NH4)2Fe(SO4)2与足量Ba(OH)2溶液在加热条件下反应的离子方程式 。
26.(19分)中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)

回答下列问题:
⑴写出甲与A的浓溶液反应的化学方程式 。
⑵C的电子式是 。
⑶写出由B生成G的离子方程式 ,除去G固体中含有H杂质采用的方法是 。
⑷A溶液与一种能使湿润的红色石蕊试纸变蓝的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示) 。
⑸写出由F转化为E的离子方程式 。
⑹4g单质甲燃烧能放出131.17kJ的热量,写出表示单质甲燃烧热的热化学方程式 。
25.(17分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
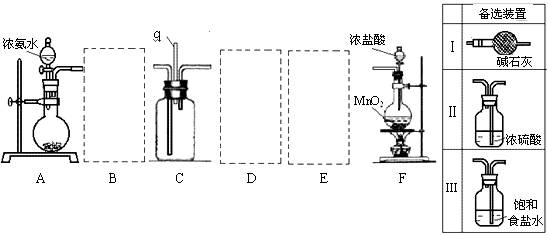
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:
。
(5)从装置C的q处逸出的尾气可能含有污染环境的气体,如何处理?
答: 。
24.(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4 ==== N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为 ( )
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
第Ⅱ卷(共62分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com