
18.(10分)甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
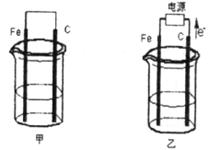
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①甲池中有红色物质析出的是__________棒;乙池中有红色物质析出的是_________棒。
②在乙池中阳极的电极反应式是___________________________________________。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式____________________________________。
②若乙池转移0.02mol电子后停止实验,阳极上产生气体的体积(标准状况下)为
_________mL。
③甲池C棒上的反应为__________________________________________。
17.用铂电极电解100mL HNO3与AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为
A.1 mol/L B.2mol/L C.2.5mol/L D.3mol/L
第Ⅱ卷(非选择题 共5 4分)
16.在密闭容中发生下列反应aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.平衡向正反应方向移动 B.A的转化率变大
C.D的体积分数变大
D.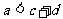
15.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验: (N2O4 2NO2
△H>0)
2NO2
△H>0)
( )将两容器置于沸水中加热
)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.( )甲>乙,(b)甲>乙
B.(
)甲>乙,(b)甲>乙
B.(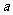 )甲>乙,(b)甲=乙
)甲>乙,(b)甲=乙
C.(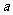 )甲<乙,(b)甲>乙 D.(
)甲<乙,(b)甲>乙 D.(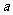 )甲>乙,(b)甲<乙
)甲>乙,(b)甲<乙
14.可以将反应Zn+Br2==ZnBr2设计成蓄电池,下列4个反应①Br2+2e==2Br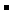
②2Br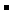 -2e
-2e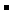 ==Br2 ③Zn-2e
==Br2 ③Zn-2e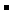 ==Zn2+ ④Zn2++2e
==Zn2+ ④Zn2++2e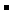 ==Zn,其中表示充电时的阳极反应和放电时的负极反应的是
==Zn,其中表示充电时的阳极反应和放电时的负极反应的是
A.②和③ B.②和① C.①和③ D.④和①
13.下列关于铜电极的叙述正确的是
A.因为金属铜能导电,所以电解水制氢气时可用铜棒作阳极
B.用电解法精炼铜时粗铜作阴极
C.在镀件上电镀铜时金属铜作阳极
D.电解某种电解质溶液时,用铜作阳极质量一定减小,作阴极质量一定不变
12.在可逆反应中,改变下列条件一定能加快反应速率的是
A.增大反应物的量 B.升高温度 C.增大压强 D.增大生成物的量
11.下列事实不能用原电池原理解释的是
A.轮船吃水线以下的船壳上装有一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快
D.镀锌铁比镀锡铁更耐用
10.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌一锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(1)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e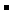 →Mn2O3(s)+2OH
→Mn2O3(s)+2OH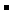 (aq)
(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
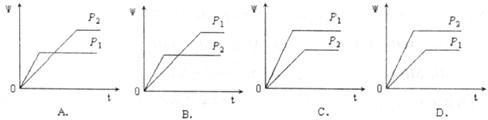
9.在一定温度不同压强(P1<P2)下,可逆反应2X(g)  2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数( )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com