
7.在一固定容积的密闭容器中充入1molNO2,一定温度下建立如下平衡:2NO2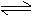 N2O4,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是 ( )
N2O4,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是 ( )
A.x>y B.x<y C.x=y D.不能确定
6.设NA为阿伏加德罗常数,下列说法中正确的是 ( )
A.在含4 mol Si-O键的SiO2晶体中,氧原子的数目为2NA
B.中和热57.3kJ/mol表示反应生成NA个水分子时一定放出57.3kJ热量
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数约为0.1 NA
D.常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积约为22.4 L
5.下列实验操作正确的是 ( )
A.使用容量瓶配制溶液,移液时应洗涤烧杯和玻璃棒2-3次
B.用50mL量筒量取2.5mL稀盐酸
C.用托盘天平称量11.50g NaCl固体
D.用托盘天平称量NaOH固体时,不能直接放在盘上称,应放在纸上称
4.下列表达方式正确的是 ( )
A.CCl4的电子式: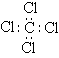 B.MgCl2的电子式:
B.MgCl2的电子式: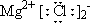
C.S2-的结构示意简图 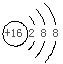 D. 中子数为20的氯原子:20Cl
D. 中子数为20的氯原子:20Cl
3.实验室中测定10000个H2O的相对分子质量,若考虑同位素的存在,已知O有两种同位素16O、18O,H有三种同位素1H、2H、3H,可测得相对分子质量有 ( )
A.1种 B.7种 C.12种 D.1000种
2.碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是 ( )
A.I2O3 B.I2O4 C.I4O7 D.I4O9
1.下列化合物中阳离子半径与阴离子半径比值最小的是 ( )
A.NaF B.MgI2 C.NaI D.KBr
23.(6分)将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、 NO2)的混合气体共A mol,将这些气体通入足量烧碱溶液,气体全部被吸收,共消耗NaOH B mol。
(1)此过程涉及有关反应的方程式:
①N2O3===2NO2;
②NO+NO2+2NaOH 2NaNO2+H2O
写出③NO2被NaOH吸收的方程式 ;
(2)若A=0.8,B=1.0时,原混合气恰好被吸收,则0.8mol混合气体中NO的物质的量为 、N2O4的物质的量为 、NO2的物质的量为 ;
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量为 、
(用含B的代数式表示)。
22.(4分)如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,电源a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电,电解一段时间后A、B中均有气体如图所示。
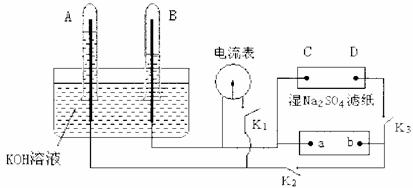
(1)电源的a极为 (填正、负极)。
(2)在湿的Na2SO4滤纸条中心滴KMnO4液滴,现象是 。
(3)写出A中电极反应式 。
(4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表的指针偏转,此时B极电极反应式为 。
21.(7分)有下列转化关系:
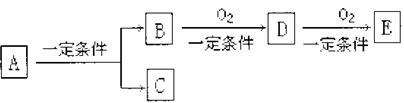
(1)若C是可用于自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量是
总质量的25.8%,则A是 (化学式),写出A在一定条件下转化为C的方程式 。
(2)若E是酸性氧化物,且易溶于浓硫酸,而A是 (化学式),D转化为E的条件是 。
(3)若C是水,B是无氧化合物,其标况下密度为1.25g/L且在同系物中是分子量最小的化合物;E能使紫色石蕊显红色,则A是 (化学式)。A、B、D、E易溶于水的是 (填化学式)。写出检验D中官能团的方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com