
3.下列除去杂质的方法不正确的是
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤
B.Cl2气体中混有少量HCl:通过碱石灰后收集气体
C.SO2气体中混有少量SO3:通过足量浓H2SO4,收集气体
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
2.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是
A.SO2、H2S、Cl2 B.NO、O2、HBr
C.SO2、CO2、O2 D.HCl、HBr、HI
1.下列关于某些社会热点问题的说法中,错误的是
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.光化学烟雾的产生与人为排放氮氧化物有关
C.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
D.甲醛是某些劣质装饰板材释放的常见污染物之一
21.(10分)在标准状况下将cmolCl2通入含a molFeBr2、b mol FeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质。(不考虑生成物与水的反应)
(1)下表中空格填满:
|
C的取值(用含A.b的代数式表示) |
反应后溶液中溶质的化学式 (只要求写盐类化合物) |
|
0<c<b |
|
b≤c<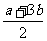 |
FeCl2、FeCl3、FeBr2、FeBr3、 |
|
|
FeBr3、FeCl3 |
c≥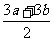 |
|
(2)若a=b=1、c=2时,反应后溶液中属于盐类的溶质是(写化学式)
(3)若a=b=1、c=2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应):
20.(10分)某种优质燃油由甲、乙两种有机物混合成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
|
物质 |
甲 |
乙 |
CO |
H2 |
|
燃烧热/kJ·mol-1 |
1366 |
5518 |
283 |
286 |
取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
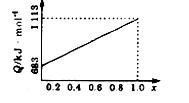
(1)乙的相对分子质量Mr(乙)= 。
(2)160g由甲、乙以等物质的量混合而成的燃油在347.2 LO2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为 。甲、乙的分子式为:甲 ;乙 。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876kJ/mol,则反应中生成CO mol。
19.(16分)某同学用如图所示装置探究SO2的性质及其有关实验。
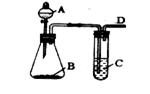
(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学反应方程式 。
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是 ,继续通入过量SO2气体,现象是 。
②SO2通入紫色KMnO4溶液,现象是 ,其反应的离子方程式为 。
③SO2慢慢地通入澄清石灰水中,现象是 。
④若C取双氧水,则通入SO2后,请大胆判断所得溶液是什么 (填溶质的化学式)若该同学制备的SO2气体中混合CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有 。要证明气体中既有SO2又有CO2,应该选用的试剂依次为 。
18.(16分)A、B、C、D、E、F是六种中学化学常见的物质,它们之间的转化关系如图所示。
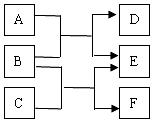
(1)若A、C、E皆为氧化物,且E为有毒气体,B、D、F皆为非金属单质,且D为气体。则A的结构式为 ,单质F的晶体类型 ,1molC中含有约 个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物,其中D、F为有毒气体。
①A、C、E沸点由高到低的顺序为 ,A、C、E三种气态氢化物稳定性最强的是 (填化学式)。其中C的电子式为 。
②B跟C反应生成E和F的化学反应方程式 。
③A跟D常温下反应可生成一种单质,其化学方程式为 。
17.(8分)某小苏打溶液中含NaHCO316.8g,加入一定质量的不同类型物质x,恰好使溶液中溶质只有Na2CO3,请你填写出x的化学式和质量。
(1)x为 时,质量为 。
(2)x为 时,质量为 。
(3)x为 时,质量为 。
(4)x为 时,质量为 。
16.半导体工业用石英砂做原料通过三个重要反应生产单质硅 ( )
SiO2+2C(c) Si(s)+2CO(g);△H +682.44KJ·mol-1
(石英砂) (粗硅)
Si(s)+2Cl2(g) SiCl4(g);△H -657.01KJ·mol-1
(粗硅)
Si Cl4(g)+2Mg(s) 2MgCl2(s)+Si(s);△H -625.63.01KJ·mol-1
(纯硅)
生产1.00kg纯硅的总反应热为 ( )
A.+2.43×104kJ B.-2.35×104kJ C.-2.23×104kJ D.-2.14×104kJ
第 Ⅱ卷(非选择题,共60分)
15.纯HClO4是水状的无色液体,沸点130℃。它的稀溶液加热时不易分解,但浓度大时(如60%以上)则很容易热分解,因接触有机物易发生爆炸。用浓H2SO4与稀的HClO4混合后蒸馏可制得相当浓的HClO4,实验时应采取的措施正确的是 ( )
A.将稀HClO4溶液与浓H2SO4混合后减压蒸馏
B.把稀HClO4注入浓H2SO4后再进行蒸馏,并把温度控制在130℃
C.可以用橡胶塞和橡皮管连接仪器
D.连接仪器的胶塞要用锡箔包好,导管口密封连接
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com