
23.(10分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
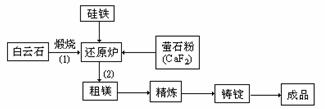
⑴在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的
反应热△H 0(填“<”、“>” 或“=”)理由是 。
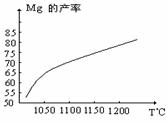
⑵还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 (填后列的选项字母):A.复盐 B.混合物 C.配合物
⑷写出下列反应的方程式
①煅烧白云石 。
②CaO•MgO与Si的反应 。
22.(10分)已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质。下表中所列四种物质都易与水反应。
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式:
|
Li3N |
ClF |
NaNH2 |
SiBr4 |
|
|
|
|
|
(2)写出这四种物质与水反应的产物中,溶于水中形成的无氧酸的化学式 。
(3)写出等物质的量这四种物质分别与水反应时,耗水量最少且产物溶于水所形成的溶液显碱性,则该产物的电子式为 。
21.(14分)茶是潮汕人民最离不开的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6-7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 、 等仪器。
步骤2中,改用试剂 (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ,被滴定的20 mL滤液中含CO32-的物质的量为 mol,试计算原500g茶叶中钙离子的质量分数为 ,计算过程如下:
20.(8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(固) 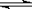 Mg2++2OH-……①
Mg2++2OH-……①
NH4++H2O 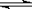 NH3·H2O+H+……
②
NH3·H2O+H+……
②
H+ + OH-  H2O…………………③
H2O…………………③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:
Mg(OH)2(固) Mg2++2OH-……①
Mg2++2OH-……①
NH4++OH-  NH3·H2O…………②
NH3·H2O…………②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式 。
19.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
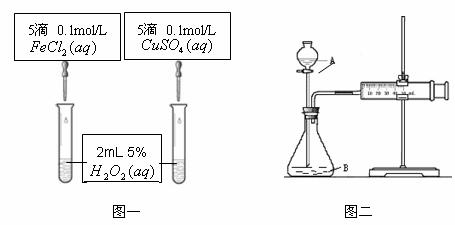
⑴可通过观察图一的现象: 定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
⑵检查图二装置气密性的方法是
。图二所示实验中需测量的数据是 。
18.在一个固定体积为2 L的密闭容器中,充入2 mol A和1 mol B,发生如下反应:
2A(g)+B(g)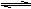 2C(g)+D(s),达到平衡时C的浓度为0.4 mol/L。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是0.4 mol/L的是
2C(g)+D(s),达到平衡时C的浓度为0.4 mol/L。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是0.4 mol/L的是
A.4 mol A+2 mol B B.2 mol C+ 0.7mol D
C.1mol A+0.5 mol B+1 mol C D.1mol A+0.5 mol B+1 mol C+0.1 mol D
第Ⅱ卷 非选择题(共87分)
17.常温下,某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH- ) 。下列判断正确的是
A.该溶液可能由0.1 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成
B.该溶液可能由0.2 mol/L的CH3COOH与0.1 mol/L的NaOH溶液等体积混合而成
C.该溶液可能由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成
D.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
16.将a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,只产生NO气体,所得澄清溶液的溶质是Fe(NO3)3、H2SO4,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b) mol ④Vc-(9a+b)/3 mol
A.①③ B.①④ C.②③ D.②④
15.有一瓶可能部分被氧化的Na2SO3溶液。某同学进行如下实验:取少量此溶液,滴入
Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.加硝酸后的白色沉淀一定是BaSO4
D.此实验不能确定Na2SO3是否部分被氧化
14.下列离子方程式的书写中,正确的是
A.向次氯酸钙溶液中通入少量的SO2 Ca2++2ClO-+SO2 CaSO3↓+2HClO
CaSO3↓+2HClO
B.向氨水中通入过量SO2
2NH3·H2O+SO2 2NH4++SO32-+H2O
2NH4++SO32-+H2O
C.向硫酸铁溶液中通入H2S
2Fe3+ +S2- S↓+2Fe2+
S↓+2Fe2+
D.向溴水中通入SO2
Br2+2H2O+SO2 4H++SO42-+2Br-
4H++SO42-+2Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com