
5.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.氢气能氧化铜中的铜还原,铜能还原硝酸银溶液中的银,所以,氢气也能还原硝酸银溶液产生金属银
B.CO2与SiO2化学式相似,故CO2与SiO2的结构、性质也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.K与Na同主族并位于Na的下方,Na常温下能与水剧烈反应,故K常温下也能与水剧烈反应
4.设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1molCl2与足量Fe反应,转移的电子数为3NA
B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D.0.10mol Na2O2粉末与足量水反应生成的O2分子数为0.10NA
3.下列叙述正确的是
A.元素的单质一定由氧化或还原该元素的化合物制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
2.下列关于化学学习和研究的说法错误的是
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明
D.化学基本原理的应用是有一定条件的
1.食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.三聚氰胺的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.淀粉的含量
29. (15分) 某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
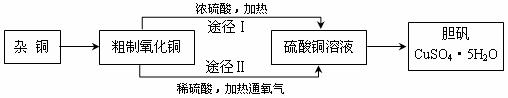
(1) 杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于______________上(用以下所给仪器的编号填入,下同),取用坩埚应使用_________,灼烧后的坩埚应放在___________上,不能直接放在桌面上。
(实验所用仪器:a. 蒸发皿 b. 石棉网 c. 泥三角 d. 表面皿 e. 坩埚钳
f. 试管夹)
(2) 杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是_______________。
A.灼烧过程中部分氧化铜被还原 B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜 D.该条件下铜无法被氧气氧化
(3) 通过途径Ⅱ实验用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_______________、冷却结晶、____________、自然干燥。
(4) 由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是_________________________________、____________________________________。
(5) 在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行_________次。
(6) 若测定结果x值偏高,可能的原因是___________。
A.加热温度过高 B.胆矾晶体的颗粒较大
C.加热后放在空气中冷却 D.胆矾晶体部分风化
28. (15分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N2 3 mol H2经过10s达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,b mol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)
容器甲10 s 内用H2表示的平均反应速率v(H2) = _________________,达平衡时N2的转化率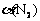 = _______________。
= _______________。
(2) 下列哪些情况表明容器乙已达平衡状态?( )
A.容器乙的气体密度不再变化
B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率
D.断裂1 mol N≡N键同时断裂6 mol N-H键
(3) 达平衡时甲容器的压强___________乙容器的压强(填“等于”、“大于”或“小于”)。
(4) a = _______________mol,b = ______________mol。
(5) 达平衡乙容器的体积为_____________L。
(6) 起始时容器乙是容器甲压强的_______________倍。
27. (16分) a、b、c、d、e为原子序数依次增大的五种短周期元素,a与b能形成原子数之
比为1∶1和2∶1的两种常见的液态化合物X、Y,c与d相邻,d的一种单质化学式为d4,易自燃,其分子结构为正四面体结构。试回答下列问题:
(1) 化合物X能被酸性KMnO4溶液氧化,写出对应的离子方程式__________________。若有16g气体生成,则转移电子的物质的量为____________mol。
(2) c与b形成的化合物z晶体类型为____________________;等物质的量的z和d4的共价键数之比为________________。
(3) 3.1g d4在空气中完全燃烧放出Q kJ的热量,则d4燃烧热的热化学方程式为:(用化学式表示各物质)______________________________________________________。
(4) d与e能形成de3和de5两种化合物,其中各原子都满足8电子结构的化合物的电子式为_________________;de5能与水反应,生成两种常见的酸,其中一种为高沸点难挥发酸,请写出对应的化学方程式___________________________________。
26. (14分) 常温时,溶液①为100 mL 0.2 mol/L NaClO溶液
溶液②为100 mL pH = 1 HNO3溶液
溶液③为溶液①和溶液②混合溶液,测其pH = 9。
(1) 溶液①显__________性(填“酸”、“中”或“碱”)。其原因是(用离子方程式表示)
______________________________________________________________________。
(2) 溶液②中由水电离出来的H+浓度c(H+) = _______________mol/L。
(3) 溶液③中:
Ⅰ.c(ClO-)__________c(NO3-)(填“大于”、“小于”或“等于”)
Ⅱ.c(ClO-) + c(HClO) = _____________ mol/L。
Ⅲ.Na+、ClO-、NO3-、OH-、H+离子浓度由大到小的顺序是:_________________。
13、 某温度下,在容积固定的密闭容器中发生下列可逆反应:X(g) + Y(g)
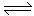 3Z(g)。平衡时X、Y、Z的物质的量分别为1 mol、2 mol、3 mol,保持温度不变,再向容器中充入2 mol X、3 mol Y,则下列叙述正确的是( )
3Z(g)。平衡时X、Y、Z的物质的量分别为1 mol、2 mol、3 mol,保持温度不变,再向容器中充入2 mol X、3 mol Y,则下列叙述正确的是( )
A.刚充入时正反应速率增大,逆反应速率减小,平衡右移
B.达新平衡时,容器内气体的平均相对分子质量增大
C.达新平衡时,容器内气体的压强大于原来两倍
D.达新平衡时,容器内气体的百分组成和原来相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com