
5.下列说法不正确的是 ( )
A.CC14是由极性键构成的非极性分子
B.胶体粒子可以透过滤纸但不能透过半透膜
C.氯水中通入SO2气体发生反应,说明C12的氧化性强于8
D.根据C(s,石墨)+O2(g)=CO2(g);△H=-393.5kJ·mol-1,可知石墨的燃烧热为393.5kJ·mol-1
4.下列各给物质中,所含化学键类型完全相同,晶体类型也相同的是 ( )
A.CO2和H2O B.NaOH和Na2O
C.NaC1和HC1 D.SO2和SiO2
3.下列关于H2O2的说法正确的是 ( )
A.H2O2和H2O互为同素异形体
B.H2O2是具有共价键的离子化合物
C.H2O2是一种具有杀菌消毒作用的强酸
D.H2O2能发生分解反应,该反应可用于实验室制氧气
2. 能源是当今社会发展的三大支柱之一。有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如下图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为 ( )
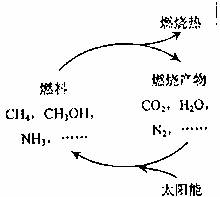
A.化学能 B.热能 C.生物能 D.电能
1.酸雨对下列物质的腐蚀作用最强的是 ( )
A.铜制塑像 B.大理石雕刻 C. 玻璃墙 D.不锈钢
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(12分)
A.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素,与实际元素符号无关。
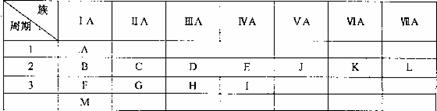
(1)下列说法正确的是 。
A.第一电离能:A>B>E>J>K B.电负性:B>C>D>E>J
C.原子半径:F>G>H>E D.1分别与L形成的简单分子均为非极性分子
(2)表中A与E可形成A2E=E=EA2分子,有关该分子的说法不正确的是 。
A.分子中有6个σ键和2个7π键 B.三个E原子都是sp2杂化
C.四个A原子不在同一平面内 D.三个E原子在同一条直线上
(3)F晶体的晶胞结构如下图,它的空间利用率为: (选填:52%、68%、74%)。

(4)字母K表示的元素原子基态时的价电子轨道排布式为: 。
(5)MAL2化合物中包含的微粒间作用力有: (用下列序号填写)。
①离子键②极性键③氢键④分子间作用力⑤金属键
(6)BHA4是一种络合物,中心原子配位数为: ,根据价层电子互斥理论可确定该物质中阴离子空间构型为 。
B.草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解技术制取草酸。
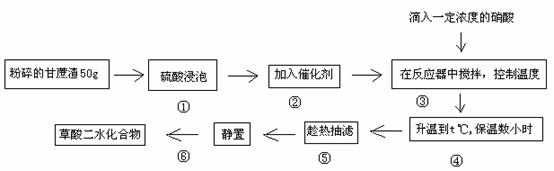
试回答下列问题
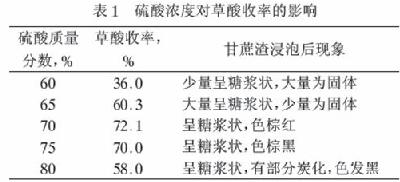
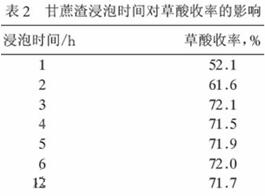
(1)第①步硫酸的主要作用是: ;由表l可确定,合适的硫酸质量分数是: (选择表中数据);由表2,合适的浸泡时间 小时。
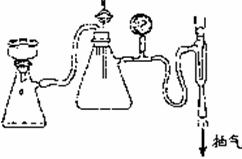
(2)步骤⑤是减压抽滤(见下图),其优点是: ;步骤⑥采用的操作方法是: 。
(3)为了确定产品中H2C2O4·2H2O的纯度,称取10.5g草酸样品,配成250mL溶液,每次实验时准确量取40.00mL草酸溶液,加入适量的稀硫酸,用0.1 mol/LKMnO4标准溶液滴定。平行滴定三次,消耗KMnO4标准溶液平均为16.00mL。下列有关说法正确的是 。
A.KMnO4标准溶液盛放在碱式滴定管中
B.可从酸式滴定管中准确放出40.00mL草酸溶液
C.该实验不需要加指示剂
D.测得产品中的草酸晶体纯度约为95.0%
20.(10分)生物乙醇可由淀粉或纤维素等生物质原料发酵获得,利用乙醇可制取氢气,也可用乙醇进行相关的化工生产。
(1)已知乙醇制取氢气有如下两条路线:
a.水蒸气催化重整:CH3CH2OH(g)+2H2O(g)→4H2(g)+2CO(g)
b.部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
原子利用率较高的是: 式(选填a或b)。
(2)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8 kJ/mol。今取2mol乙醇.40%按a式制氢.60%名按b式制氢,假定转化率均为100%,则两种制氢产生的全部气体完全燃烧产生的热量 kJ。
(3)某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇按a式和b式反应的各占50%,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定这种生物汽油中含有X、Y两种成分,X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可得到X的质量为多少吨。
19.(12分)芳樟醇是贵重的香料,它可由多种方法合成。
(1)芳樟醇的一种工业合成路线如下:CH3COCH3 HCl
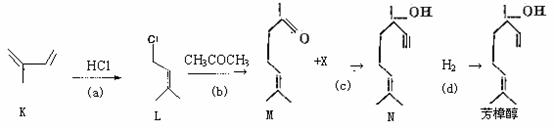
①上图中K的名称是: ;反应(b)的类型是: 。
②已知c是加成反应,反应c中另一反应物X的结构式为: 。
③L的同分异构体很多,其中只含一个甲基的链状同分异构体有: 种(不考虑立体异构)。
(2)芳樟醇的另一种常见合成路线如下:β一菠烯在600一700℃时可以开环生成月桂烯,月桂烯与HCl加成后再与CH3COONa反应转化为芳樟醇的乙酸酯,最后经水解得到芳樟醇。
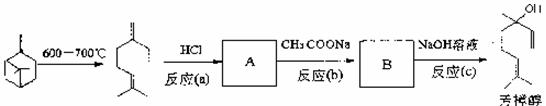
①A的结构简式为: ;②反应(c)的化学方程式为: 。
18.(10分)在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
18NO(g)+2C3O6(g)  9N2(g)+6CO2(g)+6H2O(g);△H1 ①
9N2(g)+6CO2(g)+6H2O(g);△H1 ①
18NO2(g)+4C3O6(g)  9N2(g)+12CO2(g)+12H2O(g);△H2 ②
9N2(g)+12CO2(g)+12H2O(g);△H2 ②
试探究丙烯还原NOx有关问题
(1)反应①平衡常数表达式为: 。
(2)工业上获得大量丙烯的主要途径是: 。
(3)对于可逆反应18NO(g)+2C3O6(g)  9N2(g)+6CO2(g)+6H2O(g).将NO及C3H6按物质的量之比9:1投入密闭容器中,不同的温度下在某种催化剂表面反应,NO转化率与反应温度的关系如图所示,下列说法正确的是
。
9N2(g)+6CO2(g)+6H2O(g).将NO及C3H6按物质的量之比9:1投入密闭容器中,不同的温度下在某种催化剂表面反应,NO转化率与反应温度的关系如图所示,下列说法正确的是
。
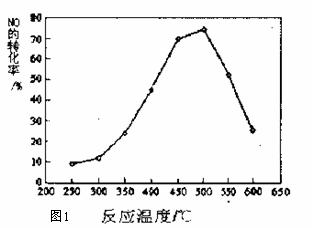
A.△Hl<0 B.若v(NO)正=2v(N2)逆带时,说明该反应已达平衡
C.该催化剂约在500℃时活性较大 D.其他条件不变时,增大压强,NO转化率提高
(4)在450℃时C3H6与NOx充入某密闭容器中,并通入少量O2,NOx转化率与O2浓度及反应温度的关系如下图。
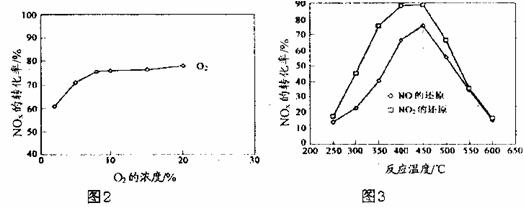
①图2的研究,可得出的结论是: 。
②图3的研究,可得出的结论是:
17.(10分)锌锰废电池可回收锌、锰元素生产出口饲料级硫酸锌及碳酸锰,工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三大部分,其中生产工业级碳酸锰工艺如下:
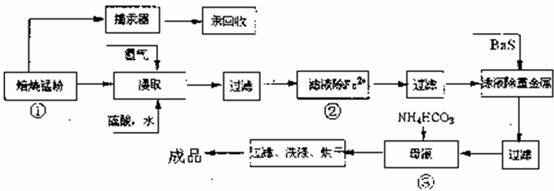
试回答下列问题
(1)硫酸锌水溶液显酸性,用离子方程式说明: 。
(2)原料锰粉粗品中主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,该反应的化学方程式为: .
(3)50-55℃向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为: 。
(4)已知三种离子沉淀的pH范围为Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe2+:7.6-9.6 .用文字和必要的方程式简述标注的步骤②除去Fe2+的方法 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com