
23.(12分)为测定某含有杂质Na2O的Na2O2样品的纯度,3个小组分别设计如下方案。首先准确称量样品mg,然后,按照以下方案进行实验:
[方案一]:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量。此方案测定的结果误差较大,主要原因是:________________________________________________;
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
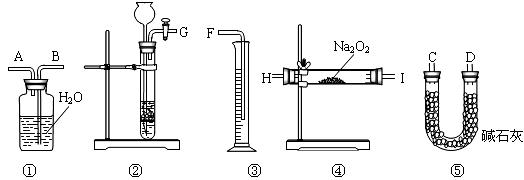
⑴按此方案,以下制取CO2和实验使用的仪器的连接次序是_______。(填写仪器编号)
⑵装置⑤的作用是:_______________。
[方案三]:测定样品与水充分反应后溶液的体积Vml。,再从中取V1mL溶液,装入锥形瓶,用标准浓度的盐酸进行滴定,确定溶液的浓度,再计算出样品中Na2O2的含量。
⑴此方案中酸碱滴定时,选用的滴定管为_________________(填仪器编号)。

⑵若用甲基橙做指示剂,达到滴定终点时的现象为______________。你认为方案二、方案三中测定结果比较准确的是___________。
22.(7分)进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。已知25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10
⑴Ba2+是有毒的重金属离子,当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若有人误将氯化钡当做食盐食用,请通过计算说明是否可以服用5%的硫酸钠溶液有效除去胃中的Ba2+。(注:5%的硫酸钠溶液物质的量浓度约0.36mol·L-1)
⑵25℃时,已知胃液的PH在0.9-1.5之间,请问_______(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_____________________。
21.(11分)有些化学反应进行时观察不到明显的现象。某兴趣小组为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计如下方案。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定混合溶液的pH,若测得pH逐渐变小且小于7,证明NaOH与稀盐酸发生了中和反应。
⑴用pH试纸测定溶液的pH时,正确的操作是:___________________。
⑵简述强调“测得的pH小于7”的理由:________________________。
方案二:在NaOH溶液中滴加几滴酚酞,溶液显红色,再滴加稀盐酸,红色逐渐消失,证明NaOH溶液与稀盐酸发生了中和反应。但该组同学在向NaOH溶液中滴加酚酞时发现氢氧化钠溶液中滴入酚酞后,溶液变成了红色,过了一会儿红色消失。该小组对这种意外现象的原因作如下猜想:
①可能是酚酞被空气中的氧气氧化,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
⑴为验证猜想①,将配制的氢氧化钠溶液加热,在液面上滴一些植物油,冷却后向溶液中再滴入酚酞。“加热”和“滴入植物油”目的是_____________________________。结果表明红色消失与空气中的氧气无关。
⑵为验证猜想②,取一定量的Na2CO3溶液,向其中滴入酚酞,发现溶液呈现红色,得出以下结论:
结论1:说明Na2CO3溶液呈______性;
结论2:说明溶液红色消失与空气中的二氧化碳无关。
(3)通过查阅资料得知:酚酞在氢氧化钠溶液浓度很大时,可能重新褪至无色。请设计实验方案证明红色消失的原因是取用的NaOH溶液浓度过大:
实验方法:_________________,观察到的现象:_______________________。
20.(9分)通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
⑴目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是___________________。
⑵科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下:
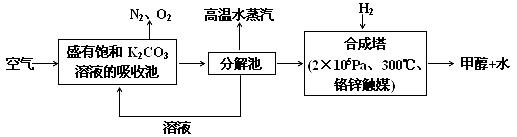
①分解池中反应的化学方程式为:_____________________________。
②合成塔中,若有4.4gCO2与足量H2恰好反应,放出4.947kJ的热量,写出该反应的热化学方程式:________________________。
⑶某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积K(sp)分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的__________溶液,实验时除测定温度、压强和空气的体积外,还需要测定_____________。
19.(12分)某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质。
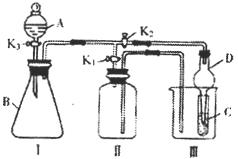
⑴关闭K2,打开K1时,可用装置I收集装置I所产生的气体,下列气体中能用此法收集的是: 。
A.O2 B.H2 C.NO D.SO2
写出实验室制备该气体的离子方程式:____________________________。
上述另外几种气体中,若在装置Ⅱ中加满水,还不能制取和收集的是________。
若要收集该气体,改进的方法是______________。
⑵利用I、Ⅲ装置比较物质的氧化性(K2打开,K1关闭):KMnO4>Cl2>Br2,在A中加浓盐酸时,应在B中加_________,C中加__________。C中的现象是_________________,
装置Ⅲ中仪器D的作用是_________________。
18.某同学拟用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应)反应为: 4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O,称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液。从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL,该样品中氯化铵的质量分数为:
A.8.92% B.89.2% C.85.6% D.92.3%
17.如图a、b、C.d均为石墨电极,通电进行电解。
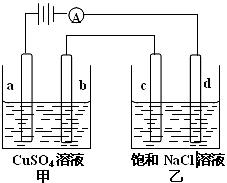
下列说法正确的是
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,C电极附近变红
C.向乙中通入适量HCl气体溶液组成可以恢复
D.当b极有64gCu析出时,C电极产生2g气体
16.某混合溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现分别取三份溶液进行如下实验:
①第一份加入AgNO3溶液有白色沉淀产生
②第二份加足量NaOH溶液加热后,得到一种刺激性气味的气体
③第三份加足量BaCl2溶液后,得白色沉淀,用足量盐酸洗涤、沉淀部分溶解。根据上述实验,对原溶液的推测不正确的是
A.一定含有Cl- B.一定不含Ba2+ C.可能含有K+ D.一定含有CO32-和SO42-
15.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
|
|
改变条件 |
新平衡与原平衡比较 |
|
A |
升高温度 |
X的转化率变小 |
|
B |
增大压强 |
X的浓度变小 |
|
C |
充入一定量Y |
Y的转化率增大 |
|
D |
使用适当催化剂 |
X的体积分数变小 |
14.下列各组溶液中,不用其它试剂即可鉴别的是(注:NaAlO2可表示为Na[Al(OH)4])
A.KOH Na2SO4 AlCl3 B.Na2CO3 Ba(OH)2 HCl
C.HCl NaAlO2 H2SO4 D.Ca(OH)2 Na2CO3 BaCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com