
19.(15分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9kJ热量,则H2燃烧的热化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)
△H=-92.4kJ/mol
2NH3(g)
△H=-92.4kJ/mol
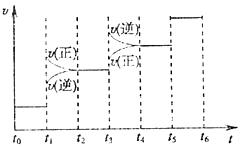
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可是 ;其中表示平衡混合物中NH3的含量最高的一段时间是 。
(3)在同一定温度下,向一个容积为1L的容器中通入2mol氮气和8mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①该反应的平衡常数为 。
②反应达到平衡时,放出热量为 (填序号)
A.小于92.4kJ B.等于92.4kJ
C.大于92.4kJ D.可能大于或小于或等于92.4kJ
③设原平衡时容器内氨气的体积分数为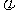 ,在相同容器中,降低温度,并且开始时通入2mol氨气和1mol氢气及固体催化剂,反应达到平衡时氨气的体积分数,下列判断正确的是 (填序号)
,在相同容器中,降低温度,并且开始时通入2mol氨气和1mol氢气及固体催化剂,反应达到平衡时氨气的体积分数,下列判断正确的是 (填序号)
A.一定等于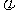 B.一定大于
B.一定大于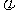
C.一定小于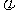 D.可能大于或小于等于
D.可能大于或小于等于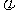
④保持同一温度,在相同的容器中,起始时通入一定物质的量的氮气、氢气、氨气,欲使平衡时氨气的体积分数也为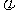 ,且起始时反应表现为向正反应方向进行,则充入氮气的物质的量a(mol)的取值范围
。
,且起始时反应表现为向正反应方向进行,则充入氮气的物质的量a(mol)的取值范围
。
18.本题包括2个小题,共20分。复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
(填编号),其pH为 (填数值);pH最大的是 (填编号);
①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律:
。
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式: 。
|
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2)这个电池的负极发生的反应是:C7H16+22O2--44e-=7CO2+8H2O
正极发生的反应是: 固体电解质里的O2-向 极移动
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
17.本题包括2个小题,共17分。
I.(11分)实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
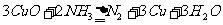
②将空气通过灼热的活性铜粉制得较纯净的N2
③加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为: 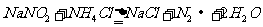
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
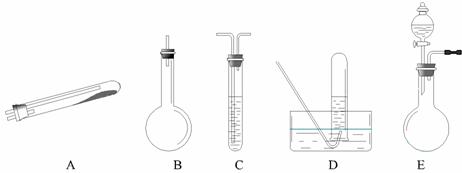
(1)按途径①制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为:
CaO+NH3·H2O===Ca(OH)2+NH3↑,最好要用上述仪器中 的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
(2)①和②两种途径常常被协同使用。这种方法与途径③相比优点是
(3)检查 E 装置气密性的方法是 。利用 E 装置还可以制取的气体有 (写出三种)。
II.(6分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的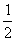 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
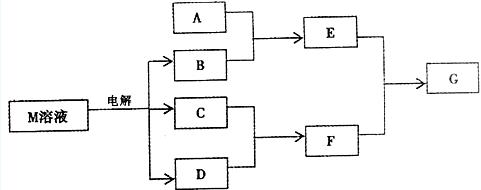
(1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是:
;
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是:
;
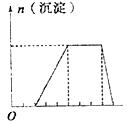
(3)若A是一个溶液,只可能含有H+、NH+4、Mg+、Fe3+、Al3+、CO2-3、SO2-4中的某些离子,当向该溶液中加入B溶液时,发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子有 。
16.下列各项所述的两个量,前者一定大于后者的是 ( )
①纯水在25℃和80℃的pH
②1mol NaHSO4和1molNa2SO4在熔化状态下的离子数
③25℃时,等体积且pH都等于3的盐酸和AlCl3的溶液中,已电离的水分子数
④Na+和F-的离子半径
A.②④ B.只有① C.①③ D.只有②
第Ⅱ卷(非选择题,共52分)
15.Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20mol3/L3。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20mol3/L3。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,使溶液的pH大于( )
A.2 B.3 C.4 D.5
14.向1.0L 0.30mol/L的NaOH溶液中缓慢通入8.8gCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是 ( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.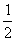 c(Na+)=c(HCO3-)+c(CO32-)+c(HCO3-)
c(Na+)=c(HCO3-)+c(CO32-)+c(HCO3-)
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
13.根据下图判断,下列说法正确的是 ( )
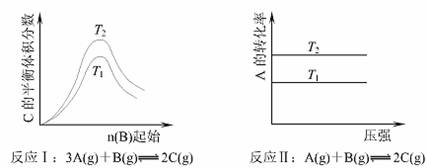
A.若反应I中△H<0,则T2>T1 B.若反应I中△H>0,则T2<T1
C.反应II的平衡不受压强的影响 D.若反应II中△H>0,则T2<T1
12.在恒温恒容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:(I)A和B的起始浓度均为2mol/L;(II)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
C(g)+3D(g)。现分别从两条途径建立平衡:(I)A和B的起始浓度均为2mol/L;(II)C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是 ( )
A.I和II两途径最终达到平衡时,体系内各气体的物质的量分别相同
B.达到平衡时,I途径混合气体密度为II途径混合气体密度的2倍
C.I和II两途径最终达到平衡时, 体系内各气体的体积分数分别相同
D.达到平衡时,I途径的反应速率v(A)等于II途径的反应速率v(B)
11.含有极性键且分子中各原子都满足8电子稳定结构的化合物是 ( )
A.CH4 B.CH2=CH2 C.CO2 D.N2
10.下列叙述正确的是 ( )
A.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:
CH3OH+6OH-+6e-===CO2+5H2O
C.在铁件上镀铜时,金属铜作阴极
D.电解精炼铜时,电解质溶液中铜离子浓度保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com