
29.(10分)为防止碘缺乏病,通常在食盐中加入“碘”。表中是食用碘盐包装上的部分说明,请根据此表,结合化学学科的知识,回答下列问题:
|
配料 |
精盐、碘酸钾、抗结剂 |
|
碘含量 |
20∽40mg/Kg |
|
储存方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)根据含碘盐的食用方法可推测其化学性质 。
(2)要检验食盐中是否含有碘元素,可以在食盐溶液中加入淀粉碘化钾溶液和稀硫酸,如果溶液变蓝色即可证明。该反应的离子方程式是 ,若要确认食盐中还含有K+,方法是 。
(3)某研究小组对该碘盐进行了分析:称取40.0g碘盐配成100ml溶液,取20.00ml该溶液于锥形瓶中,向锥形瓶中加入足量碘化钾溶液,并加入几滴稀硫酸和淀粉溶液,混合均匀后,用0.001mol/L Na2S2O3溶液进行滴定。滴定前滴定管的液面读数为2.10ml,滴定达到终点时滴定管的液面读数为17.10ml.
已知:2 Na2S2O3 + I2 = Na2S4O6 + 2NaI
通过计算判断该碘盐的含碘量是否在20∽40mg/Kg的范围内: 。
28.(15分)某校化学课外活动小组利用下图装置制备氯化铝固体,并用该固体配制氯化铝溶液。装置中a为长玻璃导管,b为玻璃活塞。实验中可供选用的试剂有:①二氧化锰固体,②铝粉,③氯化钠固体,④浓硫酸,⑤浓盐酸,⑥蒸馏水,⑦碱石灰。资料表明:氯化铝受热至180℃时即升华,在潮湿的空气中易水解。回答下列问题:
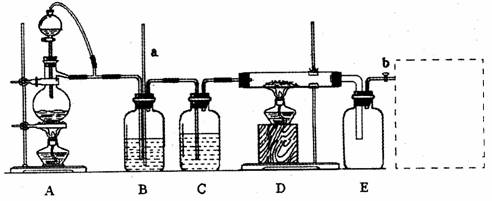
(1)检查该装置气密性的方法是: 。
(2) A中气体制备的离子方程式是: 。如果可供选择的试剂中无浓盐酸,该小组同学用已供试剂也完成了该实验,则A装置中选用的试剂是 (填序号)。
(3)实验中B装置的作用是 。
(4)D、E间导管短且粗,原因是 。
(5)用实验制得的氯化铝固体配制溶液的方法是 。
(6)请在E后的虚线框中补充完善该装置 。该装置中应盛放的试剂是 。(从题中可供试剂中选择,填序号)。
27.(19分)有一化合物X(不含结晶水),其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。请回答下列问题:
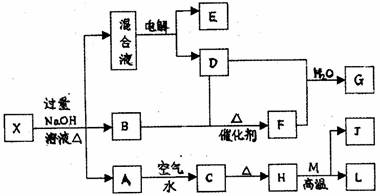
(1)B的电子式为 ,B气体的检验方法为 。
(2)电解混合液时阳极反应式为 。
(3)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应: 。
②含有L元素的置换反应: 。
(4)L与过量G的稀溶液反应的离子方程式为: 。
(5)物质X的化学式为 。
(6)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b KJ的热量,写出E燃烧热的热化学方程式: 。
26.(16分)A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,C与A同主族,A与C的最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1,常见化合物D2C2与水反应生成C的单质,且溶液能使酚酞试液变红。
(1)E在周期表中的位置是 。
(2)B的氢化物与B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,B、C的氢化物分子结合H+的能力较强的是(写化学式) ,用一个离子方程式加以证明 。
(3)一定量的D2C2与AC2反应后的固体物质恰好与含0.8mol的稀盐酸完全反应,并收集到0.25mol的气体。则该固体物质的组成是 。(用物质的量及化学式表示)
(4)化合物EC2通入到BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离子方程式为 。
13.不久前,美国一个海军航空站安装了一台250KW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔解的K2CO3,已知该电池的总反应为:2H2+O2==2H2O,负极反应为:H2+CO32--2e-==H2O+CO2,则下列推断中正确的是
A.正极反应为:4OH-===O2+2H2O+4e-
B.O2从正极通入,发生氧化反应
C.电池供应1mol水蒸气,转移的电子数4mol
D.该电池的电极没有参加反应
第Ⅱ卷(非选择题,共174分)
12.已知某可逆反应在密闭容器中进行,化学方程式为A(g)+2B(g)=3C(g)+D(g),反应放出热量。图中a曲线代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是
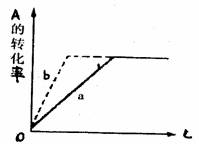
①增大A的浓度 ②缩小容器的容积 ③加入催化剂 ④升高温度
A.①③ B.②④ C.②③ D.③④
11.研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体末溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
A.铜与浓硫酸反应所得白色固体是CuSO4·5H2O
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体中夹杂的少量黑色物质是CuO
D.白色固体中夹杂的少量黑色物质中含元素Cu、S
10.下列各组离子在指定溶液中能大量共存的是
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.PH=11的溶液中:CO32-、Na+、AlO2-、NO3-
C.加入铝能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
D.酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
9.若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4 NA
③60gSiO2晶体中含有2NA个Si-O键
④某条件下,将1mol N2和3mol H2在密闭容器中充分反应,生成NH3分子数为2NA
⑤7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
A.①④ B.②③ C.③⑤ D.②⑤
8.下列有关环境问题的说法,不正确的是
A.空气中臭氧的体积分数超过10-4 %的空气有利于人体健康
B.燃煤时,加入适量石灰石,可减少废气中SO2的量
C.PH小于5、6的降水通常称为酸雨
D.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的法治污染
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com