
9.下表为元素周期表前四周期的一部分,下列关于X、Y、Z、R、W五种元素的叙述中,正确的是 ( )
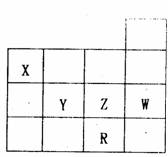
A.常压下,五种元素的单质中R单质的熔点最高
B.Y、Z阴离子的还原性比较,Z阴离子强
C.R阴离子的电子层结构与W原子相同
D.X氢化物的沸点比Z氢化物的沸点高
8.在给定的条件下,一定能大量共存的离子是 ( )
A.使甲基橙呈红色的溶液中:I-、CI-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、SO42-、HCO3-
C.由水电离出的c(H+)=1×10-12mol·L-1的溶液:K+、Cl-、NO3-、Na+
D.含有大量Al3+的溶液中:K+、Mg2+、Na+、ClO-
7.下列说法或表示方法正确的是 ( )
A.反应物总能量低于生成物总能量时,该反应就不能发生
B.强酸跟强碱反应放出的热量就是中和热
C.由石墨比金刚石稳定可知:C(石墨)=C(金刚石);△H>0
D.棉花、蚕丝和人造丝的主要成分都是纤维素
6.下列有关化学用语表达不正确的是 ( )
A.氨分子的电子式: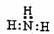 B.CS2分子的结构式:S=C=S
B.CS2分子的结构式:S=C=S
C.S2-的结构示意图: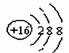 D.CH4的分子模型示意图:
D.CH4的分子模型示意图:
22.(9 分 )Mn、Fe 均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能/kJ•mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子的电子排布式为________,比较两元素的I2、I3可知,气态Mn2+ 再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是___ ______________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______________;
②六氰合亚铁离子[Fe(CN)64-]中的配体CN-中C原子的杂化轨道类型是___________,写出一种与CN-互为等电子体的单质分子的路易斯结构式______________;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为_______________;
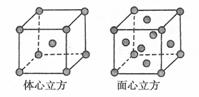
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为_____________。
21.(9分)某种芳香族化合物A,其蒸气的密度是H2的82倍。A由碳、氢、氧三种元素组成,经测定,C、H的质量分数分别为73.2% 和 7.32% 。
(1)A 的分子式是_______________。
(2)已知:①A能使FeCl3溶液变为紫色,但不能发生消去反应;
②在通常情况下,1molA 能与2molBr2发生反应;
③在一定条件下,1molA 最多能与4mol H2发生反应;
④在标准状况下,82gA跟足量的金属钠反应可以得到气体11.2 L。
则A的可能的结构简式是______________________________________(任写两种即可)。A分子中的官能团有____________________________(写结构简式)。
(3)已知
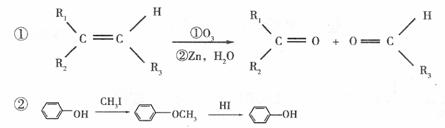
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)没有写出
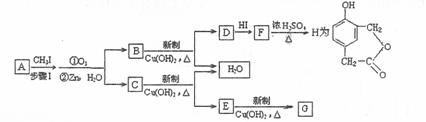
步骤I的目的是:__________________________________________;
若G的相对分子质量为44,则E的结构简式是____________________________;
写出 F → H 的化学方程式:_________________________________________________。
20.(9分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、 Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量 BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g。 [ 已知:NaAlO2+CO2+H2O → Na2CO3+Al(OH)3]
根据上述实验回答:
(1)一定不存在的离子是______________,不能确定是否存在的离子是_____________;
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号_______________,浓度______________________________;
离子符号_______________,浓度______________________________;
离子符号_______________,浓度______________________________;
(3) 试确定K+是否存在_____________(填“是”或“否”),判断的理由是_____________
______________________________________________________________________________。
19.( 10 分 )原子序数依次增大的 A、B、C、D、E、F六种短周期元素。元素A的单质是已知密度最小的气体;元素B的单质存在两种以上的同素异形体, 其中之一是自然界中硬度最大的;元素D的最外层电子数是次外层电子数的三倍,D4是新发现的一种同素异形体;E、F位于同一周期,E是同周期元素中原子半径最大的元素。
B、C、D、F四种元素均能与A形成四种等电子分子,分子中各原子的个数比为:
|
化合物 |
甲 |
乙 |
丙 |
丁 |
|
原子个数比 |
B:A=1:3 |
C:A=1:2 |
D:A=1:1 |
F:A=1:1 |
试回答:
(1)C 的元素符号为____________,元素F在元素周期表中的位置_______________,化合物乙的分子式_______________。
(2)0.lmol/L离子化合物 EAB2D4 溶液呈弱酸性,则溶液中离子浓度的大小顺序为
____________________________________________________________。
(3)化合物甲的电子式_______________,A、B、C、D 四种元素中的某三种形成的化合物也与甲分子等电子,请写出其中任意一种物质的分子式_______________。
(4)用来组成酸、碱、盐三类物质至少需要的元素有_____________(填写元素符号)。
18.(7分)强酸制弱酸是复分解反应一条重要规律。这里的“强酸”、“弱酸”指相对的强弱。甚至能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A- ===B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+) 的是____________________________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受 NH3影响可发生完全电离。在液氨中CH3COONa+HCl ===NaCl +CH3COOH这一反应能否发生___________(填“能” 或“否”),理由是_________________________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS 后,写出了化学方程式:H2S+ CuSO4===CuS↓ +H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释______________________。
(4)氧化还原反应中也有类似规律“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是______________ ( 填字母编号 ) 。
A.FeCl2 +Cl2→ FeCl3 B.Fe+I2→ FeI3
C.Fe+CuSO4→ FeSO4+Cu D.FeCl3+Cu → CuCl2+FeCl2
E.FeBr3+ Cl2→ FeCl2 + Br2 F.FeI2+ Br2→ FeBr3+I2
17.(10分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O (g) ①
CH3CH2OH(g)+3H2O (g) ①
25℃时,K=2.95×1011
2CO(g)+4H2(g)  CH3CH2OH(g)+H2O (g) ②
CH3CH2OH(g)+H2O (g) ②
25℃时,K=1.71×l022
(1)写出反应①的平衡常数表达式 K=_____________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是_____________。以 CO2为原料合成乙醇的优点是_______________________________________(写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。

根据表中数据分析:
①温度升高,K值___________(填“增大”、“减小”或“不变”)。
②提高氢碳比 [n(H2)/n(CO2)],K值__________(填“增大”、“减小”或“不变”),对生成乙醇__________(填“有利”或“不利”)。
(4)在下图的坐标系中作图说明压强变化对反应①的化学平衡的影响。图中横坐标的含义是____________________,纵坐标含义是____________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com