
6.下列有关氧化还原反应的说法正确的是 ( )
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.氧化还原反应中的反应物,不是氧化剂就是还原剂
D.非金属元素最高价氧化物的水化物并不一定都具有强氧化性
5.化学与生活、社会密切相关。下列叙述不正确的是 ( )
A.SO2、NO2或CO2都会导致酸雨的形成
B.银器久置后表面变暗,可能是发生了化学腐蚀
C.甲醛的含量属于食品安全检测的指标
D.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质
27.(8分)将32 g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO 和NO2混合气体在标准状况下的体积为13.44 L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmLa mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1 。
(3)欲使铜与硝酸反应生成的气体在溶液中全部转化为NaNO3,至少需要通入标准状况下氧气 L。
26.(6分)有硫酸、硫酸铜、硫酸铁的混合溶液100mL,已知溶液中各阳离子的物质的量浓度相等,硫酸根离子的浓度为6.0mol·L-1。求此溶液理论上最多可溶解铁粉的质量。
25.(12分)某兴趣小组设计如下图所示装置模拟工业接触法制硫酸,并测定此条件下二氧化硫的转化率。实验时观察到E中溶液褪色。回答下列问题:
|
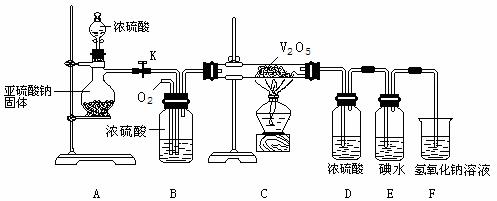
(1)写出A中发生的化学方程式:
(2)装置B有三个作用①使SO2、O2充分混合;② ③ 。
(3)装置C、D分别再现了工业制硫酸中 、 (填设备名称)中的反应。
(4)SO2能使品红溶液褪色,且加热后能恢复原颜色。若对E褪色后的溶液加热,能恢复原颜色吗?为什么?
,
(5)若实验结束后,装置D、E、F质量分别增加了a、b、c g,则SO2的转化率为: (用a、b、c中的一个或几个字母的代数式表示)。
(6)若控制SO2、O2比例时,O2速率过快,可使SO2的转化率:
(填“偏小”“偏大”“不变”)。
24.(8分)现有下列短周期元素性质的数据:
 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
试回答下列问题:
(1)上述元素中处于ⅤA族的有: (用编号表示)
(2)处于第2周期的元素有: 被称为“矾”的一类化合物中肯定含有表中 。(以上均用编号表示)
(3)写出②、⑤的元素符号: 、 。
(4)上述元素中金属性最强的是: (用元素符号表示)
(5)④和⑤两元素中非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
23.(8分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,且是一种正盐,B和G是液体,其余均为气体。根据下图关系推断:
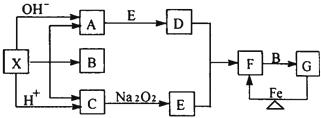
(1)写出下列物质化学式:
X____________,A___________
(2)写出A的结构式,C的电子式:A C 。
(3)写出A与E反应生成D的化学方程式_______________________________。
(4)写出G与足量Fe在加热条件下转化为F的离子方程式: 。
22.(8分)有几种元素的微粒电子层结构如图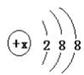 所示,其中:
所示,其中:
(1)某电中性微粒一般不和其他元素的原子反应,这种微粒符号是______ __。
(2)某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒符号是___ 。
(3)某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__ _。
(4)某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__ 。
21.(5分) 舞台上产生烟幕的方法很多,其中一种方法是在硝酸铵上覆盖一些锌粉,温热之,再加几滴水,即产生大量烟,反应为:
NH4NO3+Zn→ZnO+N2+H2O 在此反应中:
(1)被氧化的元素是 ;
(2)氧化剂是 ;
(3)烟主要由 组成。
(4)配平该反应方程式,该反应转移的电子数为:
NH4NO3 + Zn -ZnO+ N2+ H2O
19.氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生。下列叙述不正确的是 ( )
A. NH4H的电子式是: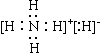
B. NH4H固体投入少量水中,有两种气体产生
C. NH4H中的H-离子半径比锂离子半径小
D. NH4H溶于水后,形成的溶液呈酸性
|
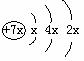 ,b与c形成的化合物为 b3c,其中b的化合价为+1。下列比较中正确的是: ( )
,b与c形成的化合物为 b3c,其中b的化合价为+1。下列比较中正确的是: ( )
A.原子半径:a>c>d B.单质的氧化性:a>c>d
C.原子序数:a>d>b>c D.最高价含氧酸的酸性:c>d>a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com