
13.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度为0.1mol·L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是 ( )
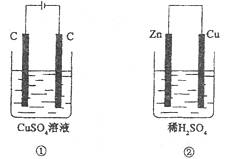
A.产生气体的体积:①>②
B.电极上析出气体物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=2H2↑
第Ⅱ卷(非选择题 共174分)
12.取浓度相等的NaOH和HCl溶液,以11:9体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 ( )
A.0.1mol/L B.0.05mol/L C.0.10mol/L D.0.50mol/L
11.等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是 ( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
10.下列叙述肯定正确的是 ( )
A.构成分子晶体的微粒一定含有共价键
B.较不活泼的金属单质不能还原较活泼的金属阳离子
C.酸和碱之间的反应都是复分解反应
D.熔化时无需破坏化学键的晶体一定是分子晶体
9.配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤
8.下列离子反应方程式正确的是 ( )
A.苛性钾溶液中加入稀醋酸:H++OH-=H2O
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液直至过量:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.氯化亚铁溶中通入氯气:Fe2++Cl2=Fe3++2Cl-
D.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
7.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 L 0.1mol·L-1的醋酸溶液中含离子和分子总数是0.1NA
B.2gD2O所含中子数为NA
C.1.8gNH2-离子中所含电子数为NA
D.标况下,22.4L氖气中所含原子数为2NA
6.下列做法会导致食品对人体有害的是 ( )
①在沥青公路上翻晒粮食
②香肠中加过量亚硝酸钠以保持肉类新鲜
③用无烟煤直接烧烤鸡、鸭
④用“瘦肉精”(一种含激素的饲料)喂养生猪
⑤用小苏打做发酵粉制面包 ⑥用乙烯催熟水果
A.①②③④ B.①②③⑤ C.②③④⑤ D.①②③④⑤
29.(15分)在室温下,向200mLCu(IO3)2饱和溶液中加入一定浓度100mL(经酸化)的KI溶液,发生如下反应:
5I- + IO3- + 6H+ = 3I2 + 3H2O
2Cu2+ + 4I- = 2CuI↓+ I2
充分反应后,再加入25.0mL 0.234mol/LKIO3溶液恰好将过量的KI反应掉。再从上述所得混合液中取出25.0mL,用0.110mol/LNa2S2O3溶液滴定,发生反应
I2 + 2S2O32- = 2I- + S4O62-
消耗了30.0mLNa2S2O3溶液。溶液体积改变忽略不计。计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.00g/cm3,Cu(IO3)2的溶解度是多少?
28.(16分)下图为从反面看到的某套实验装置示意图,无法看到实验说明,加热装置已经省略。
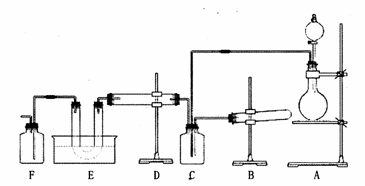
甲同学认为此套装置用于合成物质X,E处冰水冷却的U型管中有固体X出现;乙同学认为此套装置用于合成物质Y,E处冰水冷却的U型管中有红棕色气体Y生成,并且越接近U型管底部颜色越浅。对于A处,甲认为有加热装置。乙认为没有。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是 ,C装置中盛放的液体药品是 。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量。要知道A、B两个装置产物的通入量哪个大,可通过观察 得知。
(3)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时所起作用一致,那么C处的广口瓶应改为 ,所装药品为 。
(4)写出乙同学认为的D装置中发生反应的化学方程式 。为什么此时U型管中的红棕色气体越接近管底颜色越浅? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com