
8.S2C12是橙黄色液体,少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2C12说法错误的是 ( )
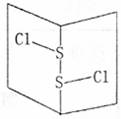
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HC1
7.关于镁和铝的叙述正确的是 ( )
A.镁、铝在常温下均能被氧气氧化 B.镁、铝均需密封保存
C.MgO和Al2O3都是碱性氧化物 D.镁铝合金的硬度比镁小
6.用下列实验装置完成对应实验(部分仪器已省略),操作正确并能达到实验目的的是( )
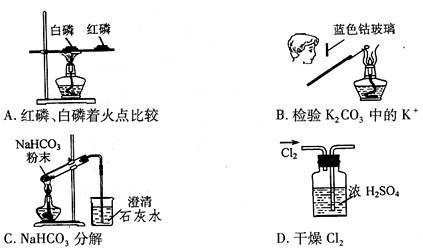
5.化学与生活是紧密相联的,下列说法正确的是 ( )
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C.现用清洁燃料主要有压缩天然气和液化石油气两类,它们均属于碳氢化合物
D.生铁在潮湿的空气中易生锈,其负极反应式为2H2O+O2+4e-=4OH-
29.(14分)
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。c、D是空气中含量最多的两种元素;D、E两单质在不同条件下反应可以生成两种不同的离子化合物。
(1)写出E的单质与A、D两元素形成的常见化合物反应的离子方程式: _____________
(2)由A、C、D三元素所形成的常见盐溶液呈_________性(填“酸”、“中”“碱”),其原因用离子方程式表示为::_______________________________。
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ·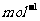 写出其燃烧的热化学方程式:_________________________________。
写出其燃烧的热化学方程式:_________________________________。
(4)X、Y是由C、D两元素组成的两种化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如下图所示:X的化学式是_________________。
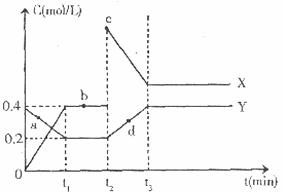
(Ⅱ)图中a、b、c、d四点中,表示反应处于平衡状态的是____________________________
(Ⅲ)反应进行到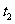 时刻,改变的条件可能是_______________________________。
时刻,改变的条件可能是_______________________________。
28.(16分)
化学活动小组想通过如下图所示装置(夹持装置已略去),进行实验,探究NO与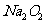 反应产物。实验前,他们查阅资料得知:
反应产物。实验前,他们查阅资料得知: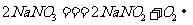 ,
,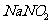 为白色粉末状固体,既有氧化性又有还原性。实验开始时,先在A装置中加入适量的碳酸钙和足量稀硝酸,待反应中不再有气体产生时,将铜丝插入稀硝酸中,回答下列问题:
为白色粉末状固体,既有氧化性又有还原性。实验开始时,先在A装置中加入适量的碳酸钙和足量稀硝酸,待反应中不再有气体产生时,将铜丝插入稀硝酸中,回答下列问题:
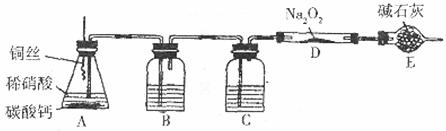
(1)装置A中放入碳酸钙的目的是______________________________________。
(2)装置B、C中的试剂分别是:B中___________,C中_________,E的作用是_____________________________________
(3)如何检验反应中是否有氧气生成?_____________
(4)假如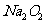 已反应完全,为确定D中固体产物的成分,甲同学将固体溶于水,测其pH,发现溶液显强碱性,再向溶液中加入酸性高锰酸钾溶液,紫色褪去。由此现象请你推断固体产物中可能含有的物质是:____________________________(填化学式)。
已反应完全,为确定D中固体产物的成分,甲同学将固体溶于水,测其pH,发现溶液显强碱性,再向溶液中加入酸性高锰酸钾溶液,紫色褪去。由此现象请你推断固体产物中可能含有的物质是:____________________________(填化学式)。
(5)乙同学取适量固体于试管中密闭加热,发现白色固体部分变淡黄色。此现象说明固体中还可能含有的成份是________(填化学式)。根据以上实验及推断,请写出NO与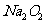 反应的化学方程式:__________________________________.
反应的化学方程式:__________________________________.
27.(14分)
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;气体C为极性分子,H为良好的耐火材料(图I中部分产物没有列出)。
请按要求回答:
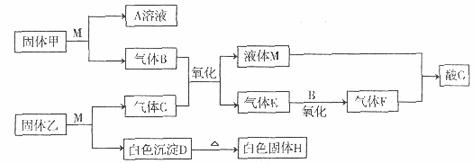
(1)写出固体甲和M反应的化学方程式:
(2)若C是酸性气体,则酸C的化学式为______,G溶液与H反应的离子方程式为:
______________________________________
(3)若C是碱性气体,且D不溶于A溶液,则固体乙与M反应的化学方程式为________;气体F与液体M反应生成G的化学方程式为:____________________。
26.(16分)
已知A、B、C、D、E五种物质分别由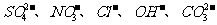 和
和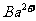 、
、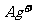 、
、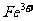 、
、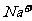 、
、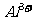 的两种离子组成,任何两种物质不含有相同的离子且各物质均易溶于水,化学小组的同学为探究上述物质的组成,进行了下列系统实验。
的两种离子组成,任何两种物质不含有相同的离子且各物质均易溶于水,化学小组的同学为探究上述物质的组成,进行了下列系统实验。
请根据实验现象,按要求回答问题。
(1)将铁粉加入到C的溶液中,振荡过滤后,溶液的质量增加,颜色也有明显的变化,则可确认C中含有_________离子,发生反应的离子方程式为_____________________ 。
(2)用pH试纸测定,只有A、E两溶液里碱性,且pH均为11,则A、E的化学式可能是:____________、__________。为进一步确认A和E,现提供蒸馏水,pH试纸,量筒等实验用品,请你设计简单的实验方案: ____________________________________。
(3)将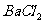 溶液分别加入B和D的溶液中,只有D溶液中产生白色沉淀,且不溶于稀硝酸。则B、C、D的化学式分别是B_________,C_________,D__________。
溶液分别加入B和D的溶液中,只有D溶液中产生白色沉淀,且不溶于稀硝酸。则B、C、D的化学式分别是B_________,C_________,D__________。
13.常温下,用惰性电极电解一定浓度的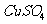 溶液一段时间后,维持温度不变向溶液中加入0.15 mol
溶液一段时间后,维持温度不变向溶液中加入0.15 mol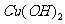 恰好使溶液恢复到电解前的浓度和质量(整个过程中其他损失不计),则在电解过程中转移电子的物质的量为
恰好使溶液恢复到电解前的浓度和质量(整个过程中其他损失不计),则在电解过程中转移电子的物质的量为
A.0.15 mol B.0.3 mol C.0.45 mol D.0.6 mol
第Ⅱ卷
(非选择题,共10个小题,共174分)
12.已知甲为恒温恒压容器,乙为恒温恒容容器,开始时,两容器的温度,体积均相同,两容器中均充入2mol 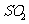 和1mol
和1mol 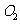 ,且发生反应为:
,且发生反应为: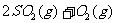

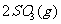 ;△H<O;当两容器都达到平衡后,为使两者中的
;△H<O;当两容器都达到平衡后,为使两者中的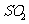 在平衡混合物中的物质的量分数相同,下列措施中可行的是
在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中再充入一定量的氦气
B.向乙容器中再充入2 mol
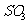 气体
气体
C.适当升高乙容器的温度
D.缩小甲容器的体积
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com