
9.下列选项中所涉及到的两个量一定相等的是
A.11.2L Cl2与4.25g NH3所含有的原子数
B.18.0g重水(D2O)与20g Ne所含有的电子数
C.标准状况下36g H2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
8.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3 ②Cu与FeCl3溶液 ③Zn与H2SO4 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
A.①② B.①③ C.③④ D.②④
7.对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
6.已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
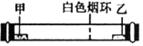
A.甲是浓氨水,乙是浓硫酸 B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸 D.甲是浓硝酸,乙是浓氨水
5.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含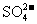
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
4.下列表述正确的是
①普通玻璃与钢化玻璃成分不同,所以性能不同,用途不同
②光导纤维导电能力很强,是非常好的通讯材料
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④氧化钴加入到普通玻璃中可制成红色玻璃
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
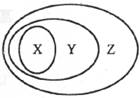
3.用下图表示的一些物质或概念间的从属关系中不正确的是
2.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
A.因海水中含有镁元素,故不需经过化学变化就可以得到金属镁
B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2
C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向
D.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
1.2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,并采用新一代的氮化镓铟高亮度LED材料。下列有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.金属铟的应用前景广阔,被誉为“21世纪金属”
23.(7分)已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能;NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg/L。为了降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a.微碱性条件下用Fe2+还原,还原产物为NH3。
b.pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c.在催化剂作用下用氢气还原,还原产物主要为N2。
(1)请写出a方案的相关反应的离子方程式: 。
(2)b方案中最好用 调节pH 。理由是 。
A.NaOH B.CaO C.NH3·H2O
(3)与b方案相比,c方案的优点是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com