
3.如下图所示,燃料在燃烧后的产物(如CO2、H2O、N2)等可以利用太阳能实现转化循环利用。则下列有关说法不正确的
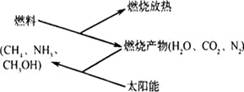
A.通过上述循环,太阳能最终转化为热能
B.所有可燃物燃烧时放出的能量均来源于太阳能
C.上述转化虽可循环,但之间的反应不属于可逆反应
D.上述转化不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机
2.以下说法中,符合科学规律的是
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使同一元素不同核素相互转化 ③改变核内质子数可使同一元素的离子间相互转化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①③ B.②④ C.①② D.①②③④
1.2008年10月10日出版的《科学》杂志上发表了美国戴顿大学教授戴黎明和佐治亚理工学院教授王中林、曲良体博士等合作研究的成果,他们用纯碳纳米材料研制出一种仿生壁虎脚,既能在垂直的表面上轻松吸附重物,也能从不同角度轻松取下。下列有关说法不正确的是
A.当碳纳米与物体表面接触时,它们之间会产生许多的范德华力
B.若将碳纳米晶体用作某些反应的催化剂时,其催化效率比普通碳高
C.碳纳米晶体管用作燃料电池负极时,可燃气体在负极上发生氧化反应
D.碳纳米晶体能与浓硫酸反应生成两种气体,但不能与浓硝酸反应
28.(15分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯气的性质。
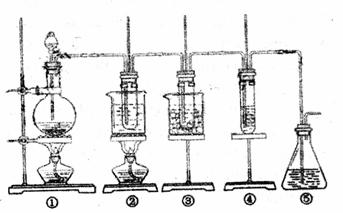
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里盛典有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有氯化亚铁溶液⑤为尾气吸收装置。
请填空下列空白:
(1)制取氯气时,在烧瓶里加一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,两者的差异是: 。
(3)本实验中制取氯酸钾的离子方程式是 。
(4)实验中可观察到④的试管里溶液的颜色从浅绿色逐渐变为 色,其原因是 ( 用离子方程式解释)。为了检验生成的物质,可加入 。
27.(本题共16分)分子式为C8H13O2C1的有机物A在不同条件下能发生如下图所示的一系列转化:
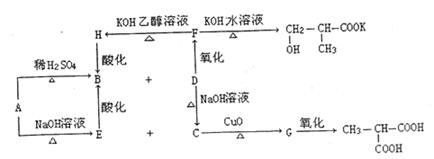
(1)写出下列有机物的结构简式
A ,
B ,
C 。
(2)用化学方程式表示下列反应
①A与NaOH溶液共热: 。
②F与KOH醇溶液共热: 。
③C→G 。
(3)G的氧化产物与C在一定条件下反应成环状化合物的化学方程式:
。
G的氧化产物与C在一定条件下反应生成环状化合物的化学方程式 。
26.(13分)某超市销售的某种食用精盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸四与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳,其回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中
b.加入适量Na2SO3稀溶液;
c.将分液漏斗充分振荡后静置,
d.分离出下层液体。
写出Na2SO3稀溶液与I2反应的离子方程式是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量。其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg
25.(18分)A、B、C、D、E、F均为短周期元素,且原子序数依次增大。A、E同主族,B、C是同周期相邻的两种元素。A、C的质子数之等于D的质子数,A+离子与D2-离子的核外电子数之和等于E+离子的核外电子数,C原子与E′离子的核外电子数之和等于F原子的核外电子数。试回答下列问题:
(1)B元素的原子核外电子排布式 。
(2)元素F在周期表中的位置为 。
(3)元素A、D、E可组成化合物甲,写出甲的电子式 。
(4)A和C的单质可化合生成乙,乙分子的空间构型是 ,已知生成1mol气态乙时,放出热量46.1kJ,写出该反应的热化学方程式 。
(5)A和D可组成原子个数比为1:1的化合物丙,将F的单质通入丙的水溶液中,生成一种强酸,且有气体放出,该反应的化学方程式是 。
(6)E和F可组成化合物丁,工业上用惰性电极电解丁和饱和溶液来制取F元素形成的单质,若电解后需将丁溶液恢复到电解前的浓度,可加入的物质是 。
(7)元素A、C、D按原子个数比4:2:3形成的化合物其水溶液呈酸性,用离子方程式解释其原因 。
24.氢化铵(NH4H)与氯化铵的结构相似,又如NH4H与水反应有氢气生成,下列叙述正确的是 ( )
A.NH4H是共价化合物
B.NH4H溶于水所形成的溶液显酸性
C.NH4H与水反应时,NH4H是氧化剂
D.NH4固体投入少量水中,有两种气体生成
第Ⅱ卷(共62分)
23.下列关于盐酸与醋酸两种稀溶液的说法正确的是 ( )
A.相同物质的量浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小
22.设NA为阿伏加德罗常数。下列叙述中正确的是 ( )
A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA
B.常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA
C.密闭容器中2molSO2和1molO2混合,在以V2O5为催化剂的条件下加热反应后,容器内物质分子数大于2NA、
D.1L 1mol/L的K2CO3溶液中离子总数小于3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com