
7.将过量的CO2通入下列溶液中,最后仍为澄清溶液的是
①CaCl2溶液 ②Ca(ClO)2溶液 ③饱和Na2CO3溶液 ④Na2SiO3溶液
⑤NaAlO2溶液 ⑥苯酚钠溶液
A.①② B.②⑤ C.①③ D.④⑥
6.下列有关物质的性质比较,不正确的是
A.熔点:Li>Cs B.还原性:F>I
C.热稳定性:H2O>H2S D.酸性:H3PO4>H3AsO4
“未来金属”钛(Ti)因具有强抗腐蚀性,一般不与稀酸反应,而广泛应用于军工、化工等领域。钛白(TiO2)是目前最好的白色颜料,且纳米TiO2光催化技术已成为解决环境问题的有效途径。
21.(12分)Ⅰ.钛白在自然界中以金红石矿存在。目前大规模生产钛的方法是:
第一步首先将金红石、炭粉混合,在高温条件下通入氯气制得TiCl4;
第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)已知:①C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(2)如何从上述所得产物中获得纯净金属钛?简述主要步骤:
。
Ⅱ.纳米TiO2可通过TiCl4水解制备:
TiCl4+4NH3+(n+2)H2O TiO2·nH2O+4NH4Cl。
TiO2·nH2O+4NH4Cl。
过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2。
(3)简述升温和调节溶液pH的目的: 。
(4)试用简要的文字和相应的离子方程式判断说明产物中无Cl-和SO42-:
。
Ⅲ.普通钛白的化学制法通常是硫酸法。首先使磨细的钛铁矿用浓硫酸在不断地通入空气搅拌的条件下进行反应,制得可溶性二水合硫酸氧盐,其反应方程式:FeTiO3+2H2SO4=FeSO4+TiOSO4·2H2O;趁热过滤,所得滤液叫钛液,加热钛液,促进水解,制得一水合二氧化钛沉淀(TiO2·H2O);然后在1173K-1223K煅烧即得普通钛白。
在制造钛白过程中,需要测定钛白Ti(Ⅳ)的含量。测定时首先取10mL钛液用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应,Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2-3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。求原钛液的物质的量浓度。
20.(8分)现有部分短周期元素的描述如下表:
|
元素编号 |
元 素 描 述 |
|
A |
人体内含量最多的元素,且其单质是常见的助燃剂 |
|
B |
形成化合物种类最多的元素 |
|
C |
短周期中,单质的导电性最强 |
|
D |
单质是最轻的气体,也是目前最清洁的能源 |
|
E |
是日常生活中接触最多的过渡金属元素,密度为7.8g/cm3 |
试回答下列问题:
(1)元素A的原子核外未成对电子有 个。元素B在周期表中的位置是
。
(2)基态E原子的核外电子排布为 。
(3)由A、C、D三种元素组成的化合物在水中存在的电离方程式为:
。
(4)只包含A 、D、E三种元素的一种化合反应的化学方程式为:
。
19.(10分)2008年9月24日,国家重点工程--川维20万吨合成氨项目顺利实现中间交接。合成氨是生产尿素、磷酸铵、硝酸铵等化学肥料的主要原料,工业生产过程是以天然气或煤炭等为原料通过水蒸气重整工艺制得氢气,然后在一定条件下与氮气进行合成制得合成氨。
(1)已知合成氨反应的热化学方程式如下:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H=-92.4KJ/mol
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t2起平衡移动的条件可能是 。其中表示平衡混合物中NH3的含量最高的一段时间是 。
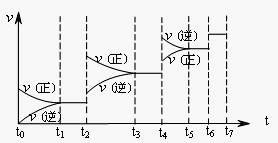
②温度为T℃时,将2amolH2和amolN2放入0 . 5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为 (用带a的代数式表示)
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、压力1.0×105 Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)==2NH3(g)+ 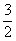 O2(g) △H1=+765.2
kJ·mol-1
O2(g) △H1=+765.2
kJ·mol-1
回答下列问题:
①试在答题纸对应的图像中用虚线表示在上述反应中使用催化剂后能量的变化情况。
②与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
元素周期表除了我们常见的常式周期表外,还有多种表现形式。下图是元素周期表的另一种画法--塔式周期表,在上面标有部分族及部分元素。
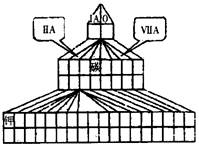
18.(10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
(1)在图中塔式周期表相应位置标出A、B、C、D 四种元素的元素符号。同时在图中将过渡元素涂黑。
(2)B与C形成的化合物的电子式为____________。
(3)图中“钾”和D形成的简单离子的半径大小为________________(用离子符号和“>”、“=”或“<”表示)。
(4)元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究方案中比较可行的是_________(填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性
(5)A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
17.(10分)某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
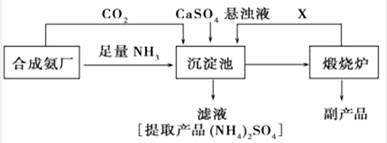
请回答以下问题:
(1)沉淀池中发生的主要反应方程式是_______________________ ,该反应能够发生的原因______________________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是____________(填写序号)。
A.蒸干 B.蒸发 C.冷却结晶 D.过滤
(3)该生产过程中可以循环使用的X是_________________________。
(4)上述生成流程中,有关NH3的作用及说明正确的是____________(填写序号)。
A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生
C.作反应的催化剂 D.生产1mol(NH4)2SO4,至少消耗2mol NH3
16.(8分)下图是一些常见元素的单质或化合物之间的转化关系(溶液中的水以及部分反应物或生成物未标出)。其中B是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数。K是两性化合物。
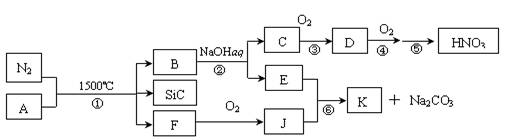
试回答下列问题:
(1)写出反应③的化学方程式: 。
(2)写出反应⑥的离子方程式: 。
(3)反应①是科学家研究开发制备新一代大规模集成电路理想的纳米级复合散热材料的最新途径。已知A由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: 。
(4)有人提出,是否可以采用在催化剂的作用下分解物质D的方法来消除其产生的污染?已知该反应△H<0,△S略≥0)。请你判断是否可行并说出理由:
______________________________________________。
15.(14分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于7”的理由: 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65﹪ |
2.00﹪ |
3.5 |
|
2 |
3.65﹪ |
4.00﹪ |
x |
|
3 |
7.30﹪ |
8.00﹪ |
14 |
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。

14.将固体MnC2O4·2H2O放在坩锅里加热,固体质量随温度变化的数据如下表:
|
温度/℃ |
25 |
50 |
75 |
100 |
214 |
280 |
|
固体质量/g |
17.9 |
17.9 |
16.0 |
14.3 |
14.3 |
7.15 |
下列说法不正确的是
A.25-50℃,MnC2O4·2H2O未发生变化
B.75℃时,MnC2O4·2H2O部分失去结晶水
C.100℃时,坩锅内固体均为MnC2O4
D.280℃时,坩锅内固体为混合物
第二卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com