
27.(14分) W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物间可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
_____>_____>______>______(用离子符号表示)。
26.(10分)甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
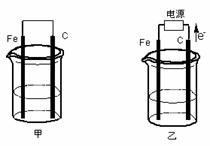
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
① 有红色物质析出的是:甲池中的 棒;乙池中的 棒。
② 在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
① 写出乙池中发生总反应的离子方程式 。
② 将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③ 若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
25.(4分)一定温度下,将1molN2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色,温度继续由T1升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化如图所示。
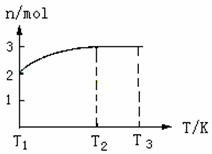
(1)温度在T1-T2之间,反应的化学方程式是___________________________。
(2)温度在T2-T3之间,气体的平均相对分子质量是(保留一位小数) ___________。
24.(6分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核,通常状况下,W为无色液体,已知:X+Y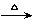 Z+W。
Z+W。
(1)X的电子式是 、Y的电子式是
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是 。
23.(8分)航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2=2H2O。
(1)酸式电池中电解质是酸,其负极反应式可表示为 ,正极反应式为 。
(2)碱式电池的电解质是碱,其正极反应式为 ,负极反应可表示为______________________________。
22.下列叙述正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其它周期均为18种元素
C.副族元素没有非金属元素
D.碱金属元素是指ⅠA族的所有的元素
21.不能用有关胶体的知识解释的现象是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与氢氧化钠溶液共煮,向反应后所得的溶液中加入食盐,有固体析出
C.在NaF溶液中滴入AgNO3溶液,看不到沉淀
D.同一支钢笔同时使用不同牌号的墨水可能发生堵塞
20.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-得,m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
19.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体。等电子体之间结构相似、物理性质相近。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3和SO2 C.CO2和N2O D.N2H4和C2H4
18.甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是
A.乙元素的族序数比甲元素的族序数大
B.甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙
C.原子半径的大小:甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com