
3.从人类健康或生活实际的角度考虑,下列叙述正确的是 ( )
A.用铝锅炒菜比用铁锅好 B.氯气泄漏后应顺风向低处跑
C.用食醋以除去水壶中的水垢 D.食用“加碘”食盐不利健康
2. “环境保护,以人为本”。新调整的北京空气质量指标中指出,影响北京空气质量的一组主要污染物是 ( )
A.CO2、N2、O2 B.SO2、NO2、可吸入颗粒物
C.CO2、O2、SO2 D.NO2、N2、可吸入颗粒物
1. 2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是( )

A.CO的铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能为人体中的血红蛋白结合
21.(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 ( )
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)不考虑其它组的实验结果,单从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)不考虑其它组的实验结果,单从丁组实验结果分析,所得混合溶液中由谁电离出的
c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A-)= mol/L
20.(16分)A、B、C、D、E为五中常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,也可组成阳离子Y,X、Y在水溶液中酸、碱性恰好相反,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素在周期表中的位置为 。
(2)B2A和X都是10电子化合物,它们的分子结合H+的能力不同,请用一个离子方程 式加以证明 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L-1W的水溶液的pH为13,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度是前者小于后者。则:
W为 ,Q为 (填化学式)。
(5)用A单质和B单质可知趣气体燃料电池,该电池用多孔的惰性电极侵入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式:
。
(6)已知工业合成X的反应方程式:D2
(g)+3B2 (g) 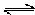 2X(g) △H=-92.4kJ/mol
2X(g) △H=-92.4kJ/mol
①在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率提高
D.达到化学平衡的过程中,气体平均相对分子质量减小
②某温度下,将10molD2,35molB2置于10L密闭容器中充分反应,15min达平衡,反应放热为462kJ,计算:该温度下的平衡常数 。
19.(8分)A、B、C、D、E、F六种中学常见的物质,皆有短周期元素组成,有转化关系:
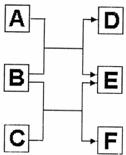
(1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气体。
①B、D、F皆为非金属单质,且D为气体。则A的结构式为 。
②B与C反应生成E和F的化学方程式为
(2)若B是由两种短周期元素组成的离子化合物,A、C为氧化物,E为气体单质,D、F是均有三种元素组成的离子化合物,它们的水溶液均呈碱性,相同浓度时D溶液的pH大于F。则:B和C反应生成E和F的化学方程式为 ,列举该反应的一种用途 。
18.(10分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器以省略),请你参与此项活动并回答相应问题。
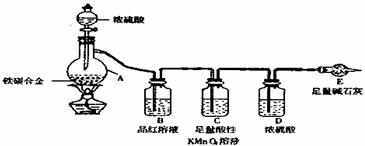
Ⅰ.探究浓硫酸的某些性质
(1)按图示的链接装置,检查装置的气密性,称量E的质量。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式 (任写一个)
B中的现象是 ,由此得到浓硫酸具有 性。
(3)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
|
(4)反应一段时间后,从A中逸出气体的速率依然较快,除因温度较高,反应放热外,
还可能的原因是 。
Ⅱ.测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。铁碳合金中铁的质量分数为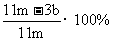 。
。
(6)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是 (填写代号)。
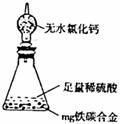
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量。
17.(6分)下列实验操作或对实验事实的描述不正确的是 (填序号)
①配置一定浓度的溶液时,俯视容量瓶的刻线,会使配置的浓度偏高。
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH) 3胶体。
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末。
④用磁坩埚熔化各种钠的化合物。
⑤实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入 少量铁粉。
⑥粗略测量溶液的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向NaOH溶液中滴加Al2 (SO4) 3溶液和向Al2 (SO4) 3溶液中滴加NaOH溶液现象不同。
⑧常温下,分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全 中和时,消耗的氢氧化钠溶液的体积前者少,后者多。
16.在密闭容器中,反应X2(g)+Y2(g)  2XY(g) △H<0,达到甲平衡时,再改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g) △H<0,达到甲平衡时,再改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
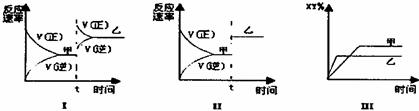
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
第Ⅱ卷 (非选择题 共52分)
15.2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
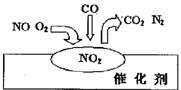
A.NO和O2必须在催化剂表面才能反应
B.NO2是该过程的中间产物
C.汽车尾气的主要污染成分包括CO和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO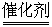 4CO+N2
4CO+N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com