
5.下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是
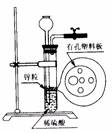
①食盐水 ②KNO3 溶液 ③适量稀硫酸铜溶液
④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤ B.②⑥ C.①③ D.①②④
4.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
3.下列表示物质结构的化学用语或模型书写正确的是
A.次氯酸的结构式:H-Cl-O B.丙烷分子的球棍模型示意图: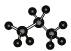
C.NH4H的电子式: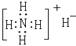 D.S2-的结构示意图:
D.S2-的结构示意图: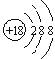
2.焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.非金属单质燃烧时火焰均为无色
B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察
D.NaC1与Na2CO3灼烧时火焰颜色相同
1.食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.二氧化硫的含量 B.蛋白质的含量
C.亚硝酸盐的含量 D.三聚氰胺的含量
23.
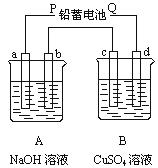
|
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应式: ;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050mol,这时电池内消耗的H2SO4的物质的量至少是 mol
22.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
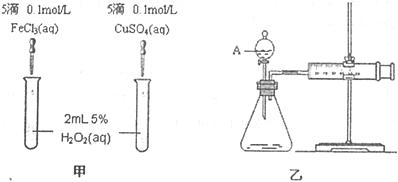
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是
,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是
,实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
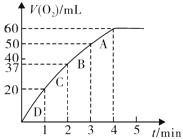
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③放出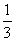 气体所需时间为 min。
气体所需时间为 min。
④反应放出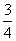 气体所需时间约为
min。
气体所需时间约为
min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因 。
⑦计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
21.(9分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K为红棕色气体、D是红棕色固体。
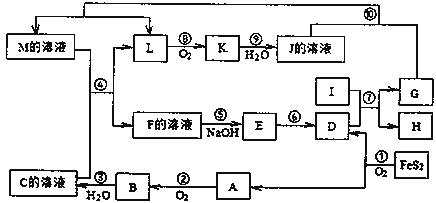
请填写下列空白:
(1)物质K的分子式为 。
(2)反应⑦的化学方程式是
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 (填写序号)
(4)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),KNO3被还原为 KNO2。请推测其余的生成物,写出化学方程式 。
20.(8分)在一定体积的密闭容器中,进行如下化学反应:
C(S)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度T的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.4 |
0.6 |
1.0 |
1.1 |
1.7 |
回答下列问题:
(1)该反应为 反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O)
d.c(H2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡向 移动(选填“正反应方向”、“逆反应方向”、“不”)。
(4)若830℃时,向容器中充入1mol CO、5mol H2,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
19.(13分)短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)
(2)指出元素D在元素周期表中的位置:第 周期第 族
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。(用离子方程式表示和适当的文字说明)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com