
33.(8分)[化学一有机化学基础]
下图是某药物中间体的结构示意图:
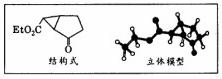
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”的结构式________;该药物中间体分子的化学式为______________________。
(2)请你根据结构示意图,推测该化合物所能发生的反应类型_____________________。
(3)解决有机分子子结构问题的最强有力手段是核磁共振氢谱(PMR)。有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积与H原子数目成正比。

现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,写出该化合物(用结构简式)与足量CH3COOH在浓H2SO4作用下反应的化学方程式:_____________________________。
32.(8分)[化学一物质结构与性质]
A、B、C、D四种元素处于同一周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻。
(1)C原子的价电子排布式为________________________________________
(2)A、B、C三种元素原子的第一电离能由大到小的顺序是(写元素符号)_____。
(3)B的单质分子中存在 个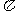 键;D的气态氢化物DH3分子中的中心原子轨道采用______杂化。B和D形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于_____________________晶体,其硬度比金刚石______________(填“大”或“小”)。
键;D的气态氢化物DH3分子中的中心原子轨道采用______杂化。B和D形成一种超硬、耐磨、耐高温的新型化合物,该化合物属于_____________________晶体,其硬度比金刚石______________(填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因是_______________________________
31.(8分)[化学-化学与技术](未命题)
30.(16分)某研究性学习小组利用所学知识进行下列实验研究。请回答下列问题:
(1)利用高锰酸钾分解制氧气,并测定高锰酸钾的质量分数。实验停止加热如图I所示(导管出口高于液面)。
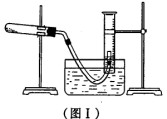
①测量收集到气体体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;
b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三步操作的正确顺序是:___________(请填写步骤代号)。
②测量收集到气体体积时,如何使量筒内外液面的高度相同?____________。
(2)为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰。“过滤”中使用的玻璃仪器是_____________________。
(3)图Ⅱ是实验室制取TiCl4的装置。四氯化钛是无色液体,沸点为1360C。它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl+H2O=TiOCl2+2HCl↑)。在6500C-8500C下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体。
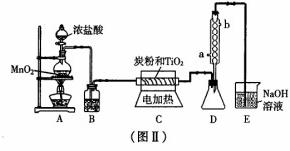
①A装置中反应的离子方程式______________________________
②B装置中的试剂及其作用是______________________________
③D装置中冷凝水的方向为_______________进_______________出。
④请指出此装置的缺陷和不妥之处
|
编号 |
装置的缺陷和不妥之处 |
|
a |
由于四氯化钛易水解,缺少阻止水蒸气进入D的装置。 |
|
b |
|
|
c |
|
[选做部分]
29.(12分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小,B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物的水化物X能与其氢化物Y反应生成盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。
(1) 写出Y和D2在催化剂作用下反应的化学方程式___________________________(用化学式表示,以下同)
(2)将X和Y的水溶液充分混合后,测得溶液的pH>7,则该溶液中离子浓度由大到小的顺序是____________________________________________。
(3)将B的某种单质作电极,电解E元素的最高价氧化物对应水化物的水溶液时,阳极的电极反应式为_____________________________________。
(4)
在一定温度下,将3 mol A2和3mol C2两种气体通人容积为lL的恒容密闭容器中,发生反应3
A2 (g)+
C2 (g) 2C A3 (g)△H=一92.4kJ/mol。当反应达到平衡时,测得容器内的压强为起始时的
2C A3 (g)△H=一92.4kJ/mol。当反应达到平衡时,测得容器内的压强为起始时的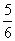 。则此时反应放出的热量为_____,该条件下反应的平衡常数K=____________(小数点后保留2位)。
。则此时反应放出的热量为_____,该条件下反应的平衡常数K=____________(小数点后保留2位)。
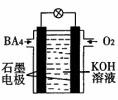
(5)燃料电池具有能量利用率高,可连续使用和污染小等优点。下图为某燃料电池结构示意图,电解质溶液为KOH溶液,电极材料为石墨,BA4和氧气源源不断地通到电极上。每消耗1molBA4时,外电路中通过电子的物质的量是_______。
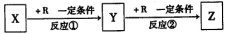
28.(14分)X、Y、Z、R均为中学化学中常见的纯净物,它们之间如下转化关系(副产物已略去)
试回答:
(1)若X是乙醇,并能与Z发生酯化反应,则Z的结构简式是___________________反应①的化学方程式是_________________________________随着我国家用汽车数量的迅猛增加,汽油用量不断增加。往汽油中添加10%至15%的酒精,既可以减少不旬再生资源石油的用量,又可以减少污染。已知4.6g酒精完全燃烧生成液态水时放出的热量为136.7kJ。请写出酒精完全燃烧的热化学方程式_ __
(2)若Z是汽车尾气中的一种有害气体,也是形成光化学烟雾和酸雨的重要原因。
X可与Z在一定条件下反应转化为对环境无污染的物质,写出该转化的化学方程式________________________________________________________
如果图中反应①与反应②转移的电子数目相同,则反应所需要的X与Y的物质的
量之比为__________________________________________________________
(3)若R是具有18电子的分子,则Z中的化学键类型是___________________。向新制的AgCl白色沉淀中,滴加Y溶液,沉淀立即转化为黑色,写出此转化的离子方程式______。
15.某同学用NaHCO3和KHCO3,组成的混合物进行实验,测得实验数据(所用盐酸的物质的量浓度相等)如下表。 ( )
|
实验编号 |
① |
② |
③ |
|
盐酸/mL |
50 |
50 |
50 |
|
混合物质量/g |
9.2 |
15.7 |
27.6 |
|
标准状况下CO2体积/L |
2.24 |
3.36 |
3.36 |
下列分析推理不正确的是 ( )
A.盐酸的物质的量浓度为3.0mol/L。
B.根据表中数据能计算出NaHCO3的质量分数
C.加入9.2g混合物时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
14.下列各组物质的溶液相互反应,无论前者逐滴滴入后者,还是后者逐滴滴入前者,反应现象均相同的是 ( )
①HCl和Na[Al(OH)4] ②Ca(HCO3)2和Ca(OH)2
③稀H2SO4和Fe(OH)3胶体 ④NaHCO3和HCl
A.①② B.②③ C.①④ D.②④
13.下列说法正确的是 ( )
A.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起同样的保护作用
B.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大
C.稀硝酸、浓硫酸均能将木炭氧化成二氧化碳
D.工业上,半导体材料硅的应用非常广泛,其制备过程不涉及氧化还原反应
12.下列离子方程式书写正确的是 ( )
A.金属钠投入CuSO4溶液中:2Na+Cu2+=2Na++Cu
B.硫酸铝溶液中加入足量氨水:Al3++4OH一=[Al(OH)4]一
C.FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.硫酸溶液中滴加足量氢氧化钡溶液:H++SO42-+Ba2++OH一=H2O+BaSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com