
28.(16分)将绿矾(FeSO4·7H2O)、硫酸铵[(NH4)2SO4]以相等物质的量混合可制得摩尔盐[FeSO4·(NH4)2SO4·6H2O]晶体。
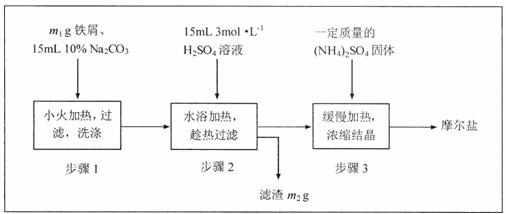
I.根据上图回答:
(1)步骤1的主要作用是_________________________________。
(2)步骤3在溶液浓缩时不能蒸发至干,为什么?
______________________________;______________________________________。
(3)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是
________________________________;_______________________________________。
Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下:
|
项目
指标 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色晶体,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20.5% |
某研究性学习小组对某硫酸铵化肥样品进行了如下实验探究:
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究] 按图示装置进行实验。
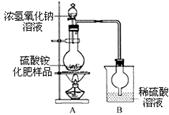
[交流讨论]
(1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:_____________________。
(2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是______。
[探究结论] 称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。则该化肥含氮量为____________,由此可判断该化肥的品质。
27.(14分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
8.1 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +C6H5ONa→NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为_________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:_________________________;将足量的KI溶液和AgCl固体混合搅拌,会观察到的现象是__________(填序号)
A.固体由白色变为蓝色 B.固体由白色变为黄色
C.固体由白色变为紫色 D.固体由白色变为浅黄色
请写出反应的离子方程式:____________________________________________。
26.(12分)短周期主族元素A、B、C、D的原子序数依次增大,它们的原子核外电子层数之和为7。B的化合物种类繁多,数目庞大。A与D能形成原子个数比为1∶l和2∶l的化合物。
(1)只由A、B、D三种元素组成,可为人体提供能量的营养物质有_________(填其中一种物质的名称)。
(2)由A、B组成的最简单化合物的化学式为____ ____,该物质与D的单质、KOH溶液组成的新型燃料电池中,正极的电极反应式为: 。
(3)某种只由A、C、D组成的盐的水溶液显酸性,其原因是 ,该溶液中各种离子的浓度由大到小的顺序是__ 。
(4)某化合物只由A、B、C、D四种元素组成,它既能与盐酸反应又能与烧碱溶液反应。已知它是一种无机酸式盐,它与盐酸反应的离子方程式是 。
13.amol FeS与bmol Fe3O4投入到V L cmol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
A.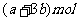 B.
B.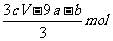
C.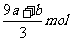 D.
D.
第II卷(非选择题)
12.固体NH4I放入一个体积为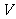 L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)
L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s) NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是
H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是
A.平衡时氨气为2.5 mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其它条件不变把容器的体积缩小到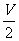 L,重新达到平衡时H2的浓度是原平衡的2倍
L,重新达到平衡时H2的浓度是原平衡的2倍
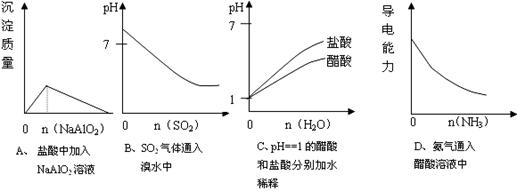
11.下列实验过程中产生的现象与对应的图形正确的是
10.下列关于实验操作的叙述中正确的是
|
B.萃取后,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.配制稀硫酸时可先在量筒加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
D.用容量瓶配某盐溶液,定容摇匀后发现凹液面最低处低于刻度线,再加水定容
9.下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO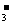 、AlO
、AlO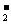 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中
C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
8.下列方程式书写正确的是
A.等体积等物质的量浓度的NaHCO3和Ba(OH)2两种溶液充分反应的化学方程式为: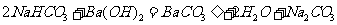
B.铝溶于烧碱溶液的离子方程式: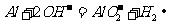
C.电解精炼铜的阴极反应式: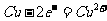
D.稀硝酸与过量铁屑反应的离子方程式:
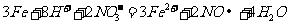
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,0.1mol的苯中含有0.3NA个碳碳双键
B.120gNaHSO4晶体中所含的离子总数为3NA
C.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.VLamoL/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com