
16.在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断不正确的是
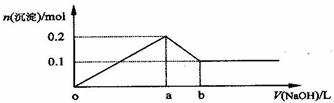
A.NaOH的浓度为0.6 mol/L
B.在a点处溶液中的溶质为NaCl
C.在b点处溶液中的溶质只有Na[Al(OH)4]
D.图中线段oa∶ab=5∶1
第II卷 (非选择题,60分)
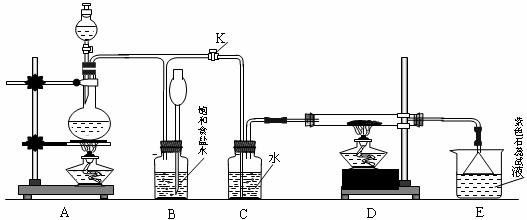
(1)A是氯气发生装置,反应的化学方程式为 。
(2)如何检查A、B装置的气密性:
(3)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2 充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。
试写出D中反应的化学方程式: ,装置C的作用是 。
(4)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色。
其原因是 。
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用。A处仍有Cl2 产生,此时B中的现象是 ,B的作用是 。
(6)若实验中使12mol·L-1 浓盐酸10mL与足量的MnO2 反应。则生成的Cl2 的物质的量总是小于0.03mol,试分析可能存在的原因是① ,
② 。欲使反应生成的Cl2 的物质的量最大程度的接近0.03mol。则实验中应采取的措施是____________ 。
15.下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④碱性:Ca(OH)2 >Mg(OH)2
A.①③ B.②④ C.①④ D.②③
14.a、b、c、d、e分别是Cu、Ag、Fe、A1、Mg五种金属中的一种。已知:①a、c皆能与稀硫酸反应放出气体;②b与d用导线连接,插入d的硝酸盐溶液中,电子流向为由b沿导线流向d.③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
A.Fe Cu Al Ag Mg B.A1 Cu Mg Ag Fe
C.Mg Cu A1 Ag Fe D.Ma Ag A1 Cu Fe
13.在一密封的烧瓶中注入NO2,在25°C 时建立平衡状态,若把烧瓶置于100°C 的水中,则下列说法正确的是
A.烧瓶中混合气体的颜色变浅
B.烧瓶中混合气体密度变小
C.烧瓶中混合气体的平均分子质量不变
D.烧瓶中N2O4的质量变小
12.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有
A.能与水反应 B.能与氢氧化钠反应
C.能与硫酸反应 D.不可能与碳酸钠反应
11.下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除第一周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
10.下列说法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na 和Cs 属于第IA 族元素,Cs 失电子能力比Na的强
D.P 和As属于第VA 族元素,H3PO4酸性比H3AsO4的弱
9.已知1~18号元素的离子aA2+、bB+ 、 cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:r(A)>r(B)>r(D)>r(C)
B.单质的还原性:A>B>D>C
C.离子半径:r(C3-)>r(D-)>r(B+)>r(A2+)
D.原子序数:d>c>b>a
8.在反应过程中,破坏1molH2中的化学键消耗的能量为Q1,破坏1molCl2中的化学键消耗的能量为Q2,生成1molHCl中的化学键释放的能量为Q3。下列关系式中正确的是
A.Q1+Q2>Q3 B.Q1+Q2>2Q3
C.Q1+Q2<Q3 D.Q1+Q2<2Q3
7.下列说法正确的是
A.金属元素与非金属元素不能形成共价化合物
B.化学反应进行得越快、越彻底不一定就越好
C.离子化合物中不一定存在离子键
D.人们所使用的物质,都是纯度越高越好
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com