
10.有机物M的结构简式为: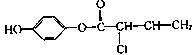 ,有关M的叙述中正确的是
,有关M的叙述中正确的是
( )
A.可与H2反应,1molM最多消耗1molH2
B.可与浓溴水反应,1molM最多消耗4mol Br2
C.可与NaOH溶液反应,1mol M最多消耗4molNaOH
D.常温下,M在水中的溶解订大于苯酚在水中的溶解度
9.对于反应A(s)+2B(g) 3C(g);△H>0,C的含量(C%)跟外界条件X、Y的关系如图所示,下列结论正确的是 ( )
3C(g);△H>0,C的含量(C%)跟外界条件X、Y的关系如图所示,下列结论正确的是 ( )
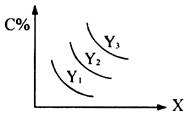
A.Y表示温度,X表示压强,且Y3>Y2>Y1
B.Y表示压强,X表示温度,且Y3>Y2>Y1
C.X表示压强,Y表示温度,且Y1>Y2>Y3
D.X表示温度,Y表示压强,且Y1>Y2>Y3
8.强氧化剂PbO2在酸性溶液中可将Mn2+氧化成MnO-4。取一支试管,加入适量PbO2固体和2mL 6mol/LH2SO4,然后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是 ( )
A.充分振荡后静置,溶液颜色变为紫色
B.若上述实验完全反应,消耗PbO2的物质的量为0.01mol
C.上述实验不能用盐酸代替硫酸
D.在酸性条件下,PbO2的氧化性比MnO-4的氧化性强
7.观察下列模型并结合有关信息进行判断,下列说法错误的是 ( )
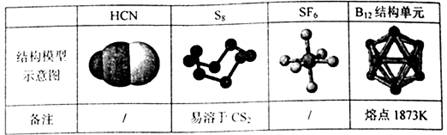
A.HCN的结构式为H-C N
N
B.固态硫S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属原子晶体,结构单元中含有30个B-B键,20个正三角形
6.盘点2008,下列说法正确的是 ( )
A.08年10月以后,北京小汽车仍将按车牌号限时行驶,提倡公民坐公交车,这体现了世界能源危机,符合节约型社会的需要
B.08年10月8日瑞典皇家科学院将2008年诺贝尔化学奖授予华裔科学家钱永键、日本科学家下村修和养国科学家马丁·沙尔菲三人,这体现了科学无国界,国际间也要注重科技合作、科技继承与创新
C.08年6月1日起,我国开始实施“限塑令”,在商场购物,顾客所要塑料袋需付费使用,目的是拉动内需,应对08年开始的世界金融危机
D.三聚氰胺(C3N6H6)俗称“蛋白精”,加入到奶粉中,目的是提高含氮量,即提高蛋白质的含量,口感舒适,便于饮用
33.(8分)[化学-有机化学基础]
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
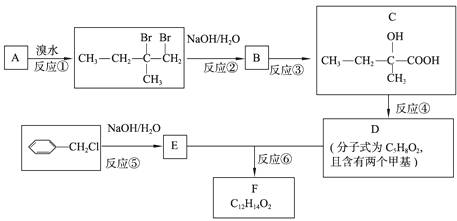
试回答下列问题:
(1)若A物质与H2发生加成反应,产物的名称为 ;C物质中含有的官能团名称是 ;
(2)合成路线中反应③所属反应类型名称为 ;
(3)反应④的化学方程式为 ;
(4)按要求写出E的一种同分异构体的结构简式。
要求:① 属于芳香族化合物。② 遇浓溴水能产生白色沉淀。 。
32.(8分)[化学-物质结构与性质]
(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的中心离子微粒的电子排布式
为 。已知SCN-呈线性结构,HSCN分子属于
(填“极性”或“非极性”)分子。
(2)有两种活性反应中间体离子,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

(3)某研究性学习小组的下列研究结论中,正确的是 ;(填字母序号)
A.两个原子之间只有在形成δ键之后才能形成π键,即不可能单独存在π键而无δ键
B.NaCl晶体结构中,Na+(小黑点)与Cl-(小白圈)的位置关系如下图所示
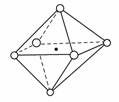
C.同周期元素原子的第一电离能从左到右依次增大
(4)取一定量的HF气体,分别在25℃、80℃、100℃时,测其相对分子质量分别为:58、20.6、20。温度不同时,测出的相对分子质量数值不同的原因是 。
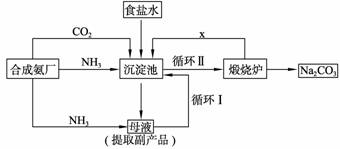
31.(8分)[化学-化学与技术]
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:
|
(2)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大NH4+的浓度,使 NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
30.(14分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是 (填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:废水100 mL试剂XSO42- ⅰ加盐酸
ⅱ加BaCl2溶液 ⅲ系列操作固体称量
计算

试剂X从下列试剂中选择:
a.0.1 mol·L-1KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1NaOH溶液
c.新制氯水 d.KI溶液
① 加入试剂X后生成SO42-的离子方程式为 ;
② 甲组方案中,第ⅲ步的“系列操作”包含的操作名称各为 ;
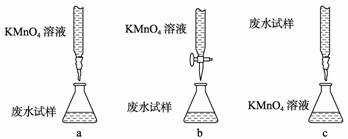
乙组方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4
(H2SO4酸化)溶液进行滴定;(有关反应为:
2MnO-4+5SO2-3+6H-=2Mn2++5SO2-4+3H2O)
ⅲ.记录数据,计算。
③ 乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加1 mol·L-1的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4)用下图装置进行CO2性质的有关实验。
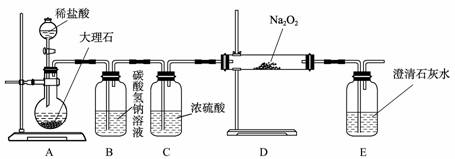
① 试剂瓶B中盛有饱和NaHCO3溶液,其目的是 ;
② 反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题作答。
29.(16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1)已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
① 含Fe2+,不含Fe3+② 含Fe3+,不含Br- ③ 含Fe3+,含有Br-
(2)773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
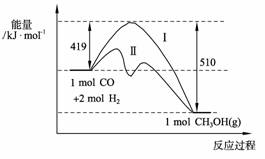
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a.使用催化剂,使反应CO(g)+2H2(g) CH3OH(g)ΔH>-91 kJ·mol-1
CH3OH(g)ΔH>-91 kJ·mol-1
b.使用催化剂, 能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
(3)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图所示。
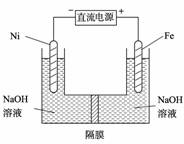
① Fe电极作极 (填“阴”或“阳”);
② Ni电极的电极反应式为: 。
(4)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的 (填化学式)能使上述还原过程发生。
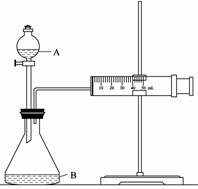
② 欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com