
30.工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:①C+O2→CO2,②CaCO3→CO2↑+CaO(保留2位有效数字)
(1)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是 。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率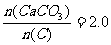 时,窑气中CO2的最大体积分数为
。(设空气只含N2与O2,且体积比为4:1,下同)
时,窑气中CO2的最大体积分数为
。(设空气只含N2与O2,且体积比为4:1,下同)
(3)某次窑气成分如下:O22.0%,CO2.0%,CO241.6%,其余为N2(CaCO3和C在石灰窑中完全反应)。则此次窑内配比率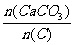 为何值?
为何值?
29.已知一个碳原子上连有两个羟基时,易发生下列转化:
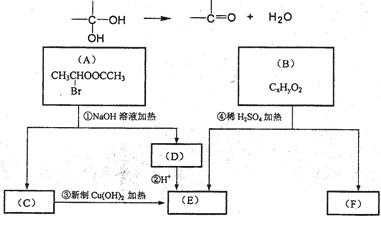
请根据下图回答。
(1)E中含有的官能团名称是 ;③的反应类型是 。
C跟新制的氢氧化铜反应的化学方程式为 ;
(2)在化学上某些分子的式量可以辅助我们推断该分子组成,已知B(CxHyO2)分子的相对式量为162,则B的分子式为 。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键技术。B分子中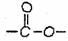 断键水解生成E、F,F就是生产这种高分子光阻剂的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为:
断键水解生成E、F,F就是生产这种高分子光阻剂的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为:
。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有_________种结构,写出其中不含甲基的同分异构体的结构简式: 。
28.乙基香草醛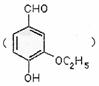 是食品添加剂的增香原料,其香味比香草醛更加浓郁。
是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中两种含氧官能团的名称 。
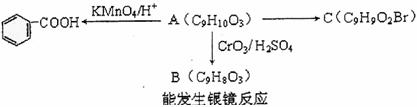
(2)乙基香草醋的同分异构体A是一种有机酸,A可发生以下变化:
提示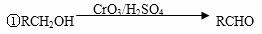
②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基
(a)由A→C的反应属于 (填反应类型)
(b)写出A的结构简式 。
(3)乙基香草醛的另一种同分异构体D(CH3O-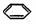 -COOCH3)是一种医药中间体,请设计合理方案用茴香醛
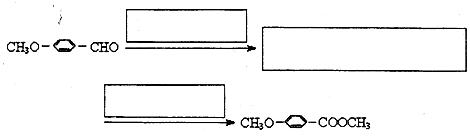
-COOCH3)是一种医药中间体,请设计合理方案用茴香醛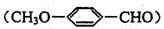 合成D。用反应流程图表示如下,请将反应条件、原料(自选)及中间产物,填在下面的方框中。
合成D。用反应流程图表示如下,请将反应条件、原料(自选)及中间产物,填在下面的方框中。
27.红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也和作氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
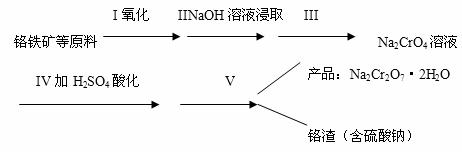
回答下列问题:
(1)步骤I中反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2在常温下该反应速率极慢,下列措施中能使反应速率增大的是 。(填字母)
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤III需将溶液的pH调至7-8,并煮沸,其目的是 。
(3)步骤IV中发生反应的离子方程式为 。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1:2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体。
Na2Cr2O7+2KCl→K2Cr2O7+2NaCl
(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大。)
请填写表中空格。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
|
|
② |
|
将所得溶液转移至蒸发皿中,加热蒸发溶液,使NaCl结晶析出 |
|
③ |
过滤 |
趁热过滤,将NaCl晶体与溶液分离 |
|
④ |
|
冷却滤液使K2Cr2O7结晶析出 |
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
26.利用下图所示实验装置可以测定一定条件下1mol气体的体积,图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线。将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积。
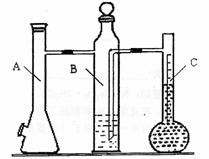
实验步骤(1)装配好化学反应气体体积测定仪,作气密性检查。
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格。
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20ml水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口。
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平。
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将硫酸注入A瓶,注入后迅速拔出针头。
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格。
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格。
重复上述操作进行第二次实验,避免偶然误差。
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa。该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格。
(2)B中所装液体一般是 (填“水”或“品红”)。
A中发生反应的离子方程式为 。
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg) g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
氢气体积ml |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
X |
|
|
2 |
0.115 |
10.0 |
121.0 |
8.0 |
|
|
①上表中X= 。
②计算1mol氢气体积两次实验的平均值= L。
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误差的可能原因 (填字母)
A.镁带中含有跟硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝 D.所用稀硫酸不足量
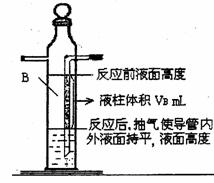
|
|
实验次数 |
m(Mg) g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
B瓶的一段液柱体积ml |
水汽体积百分含量 |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
VB |
a% |
|
1mol氢气体积= L(填写数学表达式)。
25.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)该反应的化学平衡常数表达式为K= 。
(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |
24.某一反应体系中有反应物和生成物共6种:HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe2(SO4)3,在反应后的溶液中滴加KSCN溶液不显红色。
(1)该反应中,被氧化的元素是 ,氧化剂是 。
(2)在该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)FeSO4可用于制墨水、颜料、补血剂等,它易被氧化。FeSO4遇H2SO4(浓)、HNO3时反应的产物是N2O3、H2O、Fe2(SO4)3,则该反应中还原剂与氧化剂的物质的量之比为 。
23.四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有共同元素是 (填名称)。
(2)B元素在周期表中的位置 ,写出A原子的电子排布式 。
(3)上述元素的原子M层有一个未成对P电子数的是 (填元素符号)。
(4)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(5)A、B、C分别和D形成的化合物a、b、c。这些化合物分子的沸为的高低顺序可能为 。
A.a>b>c B.b>c>a C.a>c>b D.c>b<a
22.在工业制取硫酸生产过程中,测得在进入接触室时混合气体(396K、8kPa,主要成分为SO2、O2、N2)的流量为1.0m3·s-1,从接角室导出的气体(792K、8kPa)的流量为1.8m3·s-1。且已知:在一定条件下,气体的体积和温度成正比。据此推测以下说法中正确的是( )
A.单位时间内进入接触室的气体与从接触室导出的气体的物质的量之比为10:9
B.导出气体中SO3所占的体积分数为9/2
C.混合气体中有20%SO2反应转化为SO3
D.SO2催化氧化反应是放热反应
第Ⅱ卷(共84分)
21.在固定容积的密闭容器中,可逆反应2X+Y(g)  Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是 ( )
Z(s)已达到平衡,此时升高温度则气体混合物的密度增大。下列叙述正确的是 ( )
A.若X为非气态,则正反应为吸热反应
B.正反应为放热反应,X一定为气态
C.正反应为放热反应,X可能是气态、液态或固态
D.若加入少量的Z,该平衡向左移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com