
16.(10分)A-G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。
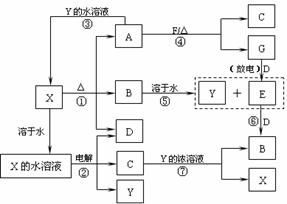
试填空。
(1)写出G分子的电子式 。
(2)写出反应⑦的离子方程式 。
(3)写出电解X溶液的阳极反应式 。
(4)写出反应④的化学方程式 。
(5)若使F按下列途径完全转化为Y。
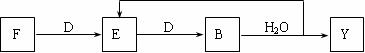
则参加反应的F与整个过程中消耗D的物质的量之比为: 。
15.(10分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
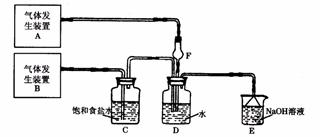
试填空。
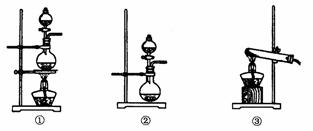
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是: ;发生装置B应选择以下三种装置中的_____(选填序号)。
(2)D装置中主要反应的离子方程式为___________________ ________。
(3)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
|
若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,发生的现象是: 。
14.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是 ( )
A.甲组和乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为0.8 mol·L―1
C.合金中镁铝的物质的量之比为1∶1
D.丙组中铝的物质的量为0.009 mol
非选择题(共72分)
13.关于下列四个图像的说法中正确的是 ( )
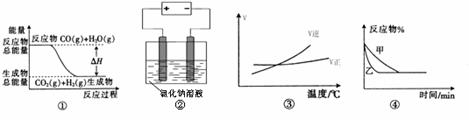
A.图①表示可逆反应“CO(g)+ H2O(g) CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH小于0
2AB3(g)”的ΔH小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
12.下列叙述正确的是 ( )
A.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2
B.10 mL 0.10 mol·L―1 CH3COOH溶液加入等物质的量的NaOH后,溶液中有
c(Na+)>c(CH3COO-)>c(OH->c(H+)
C.在0.1 mol·L―1 NaHSO3溶液中有c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3)
D.pH<7的某二元弱酸的酸式盐NaHA溶液中有 c(H+) + 2c(A2-) = c(OH-) + c(H2A)
11.2008年诺贝尔化学奖表彰了发现和研究绿色荧光蛋白质(GFP)的科学家。据研究报道:GFP在厌氧条件下不能发射荧光,而增加氧分子会渐渐开始发光。生色团是GFP发出荧光的物质基础,如下图所示的结构形成了GFP生色团的核心。
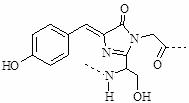
下列有关GFP的说法正确的是 ( )
A.遇强还原剂Na2SO3 或FeSO4时,GFP会发射更强荧光
B.该生色团的肽链结构中含有甘氨酸单元
C.该生色团结构中没有手性碳原子
D.温度超过70℃时,GFP因变性其荧光会消失
10.下列离子方程式书写正确的是 ( )
A.过量的氯气通入FeCl2溶液中反应:Fe2+ + Cl2 = Fe3+ + 2Cl-
B.将数滴乙醛溶液滴加到呈碱性的新制氢氧化铜悬浊液里并加热产生砖红色沉淀:
2Cu(OH)2 + CH3CHO
+OH― Cu2O↓ + CH3COO― + 3H2O
Cu2O↓ + CH3COO― + 3H2O
C.向偏铝酸钠溶液中通入少量二氧化碳:AlO2-+ CO2 + 2H2O = Al(OH)3↓+HCO3-
D.碳酸钠溶液中加入少量的苯酚:CO32- +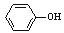 →
→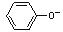 + HCO3-
+ HCO3-
9.氯乙酸ClCH2COOH的酸性强于CH3COOH,这是因为C1是一种强吸电子基团,能使-OH上的H原子具有更大的活动性,有的基团属于斥电子基团,能减弱-OH上的H原子的活动性,这些作用统称为“诱导效应”,请根据以上规律对下列说法作出判断,其中错误的说法是 ( )
A.已知-C6H5属于吸电子基团,故C6H5COOH的酸性比CH3COOH强
B.CH3COOH的酸性弱于HCOOH,是由于CH3COOH分子存在斥电子基团甲基的缘故
C.HCOOH显酸性,而H2O显中性,是由于HCOOH分子中存在吸电子基团羧基的缘故
D.下列酸中:CF3COOH、CC13COOH、CHC12COOH,酸性最强的是CF3COOH
8.下述实验不能达到预期实验目的的是 ( )
|
序号 |
实验内容 |
实验目的 |
|
A |
将2.5g CuSO4·5H2O溶解在97.5g 水中 |
配制质量分数为1.6%的CuSO4溶液 |
|
B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
|
C |
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
|
D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
不定项选择题 本题包括6小题,每小题4分,共计24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
3Zn + 2K2FeO4
+ 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
下列叙述错误的是 ( )
A.放电时负极反应为:Zn ― 2e- + 2OH- = Zn(OH)2
B.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
C.充电时阳极反应为:Fe(OH)3 ― 3e-
+ 5 OH- = FeO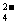 + 4H2O
+ 4H2O
D.充电时阴极附近溶液的碱性增强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com