
7.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.1NA
B.1 molNa2O2与足量的水反应,转移的电子数为2NA
C.1 mol金刚石中含有的共价键数目为4NA
D.常温常压下,62 g白磷分子(  )中的共价键数为3NA
)中的共价键数为3NA
6.2008年发生的“结石宝宝”事件,是不法分子在奶粉中掺入了不可食用的三聚氰胺而造成的。三聚氰胺又称为“蛋白精”,其结构如下图所示。下列有关三聚氰胺的叙述正确的是 ( )

A.三聚氰胺属于高分子化合物 B.三聚氰胺属于蛋白质
C.三聚氰胺的化学式为C3H6N6 D.三聚氰胺是苯的衍生物
29.(5分)已知具有碳碳双键结构的有机物可被弱碱性高锰酸钾溶液氧化成二元醇,如:
CH2=CH2 HOCH2CH2OH。现以
HOCH2CH2OH。现以 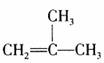 为原料按下列方式合成环状化合物F和高分子化合物E。
为原料按下列方式合成环状化合物F和高分子化合物E。
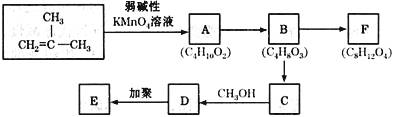
(1)A→B的反应类型是 ,C→D的反应类型是 。
(2)E的结构简式是 。
(3)B→C的化学方程式是 。
(4)B→F的化学方程式是 。
(5)B物质的同分异构体中,与B的含官能团种类、数目都相同的同分异构体有 种
(不包括B)
28.(16分)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O
+ NaCl(饱和)  NaHCO3(晶体)↓ + NH4Cl
NaHCO3(晶体)↓ + NH4Cl
(1)某校学生实验小组利用上述反应原理,设计下图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
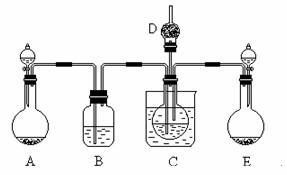
可选用的药品有:
a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。
① A中制备气体时,所需药品是(选填字母序号) ;
② B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为
;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。然后进行如图所示实验:

①在操作II中,为了判断加入氢氧化钡溶液是否过量,其中正确的操作是(选填字母序号) ;
A.在加入氢氧化钡溶液后,振荡、静置,向溶液中继续加入少量氢氧化钡溶液
B.在加入氢氧化钡溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氢氧化钡溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③计算所得晶体中碳酸氢钠纯度的数学表达式为 。
27.(15分)
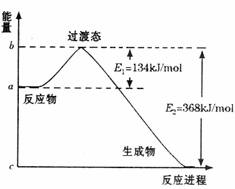
(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
(2)我国实施“嫦娥探月”行动的长征火箭中使用二甲肼[(CH3)2N-NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)=N2(g)+2CO2(g)+12H2O(g);△H=-2500kJ/mol。如果1mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q 2500kJ(填“<”、“>”或“=”)
(3)恒温恒容下,2molH2与2molN2反应达到平衡时,N2为1.8mol,H2的转化率为 ;若该反应在恒温恒压条件下进行(其它条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率 (填“大”或“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,正极上发生反应的电极反应式为 。
26.(14分)X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素。X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂。Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10。请填空:
(1)固态的XY2属于 晶体。
(2)若W的单质是有毒气体,则它与强碱稀溶液反应的离子方程式为
;
由Z和Y可构成具有漂白作用的化合物,其电子式为 。
(3)若W的单质为淡黄色固体,且W与X可形成化合物XW2。
①XW2为 (填“极性”或“非极性”)分子;
②Z的单质在XY2气体中燃烧的现象为 。
(4)若W元素可形成两种常见的同素异形体,其中一种可用于制造燃烧弹和烟幕弹等,实验室里少量该单质应保存在 中。Z的最高价氧化物的水化物与NaOH溶液反应的离子方程式为 。
2.答卷前将答题纸密封线内的项目填写清楚。
1.用钢笔或圆珠笔直接答在试题卷中。
13.下列说法正确的是 ( )
A.将pH试纸浸在溶液中,观察其颜色变化,再跟标准比色卡比较,测该溶液的pH
B.电解饱和食盐水时,阴极室得到氢氧化钠溶液和氢气
C.铁器上镀银,必须把铁器接电源的正极,银接电源负极,用含银离子的可溶性盐溶液做电解液
D.用盐酸滴定NaOH溶液的实验中,锥形瓶用水洗后,再用NaOH溶液润洗2~3次
第Ⅱ卷(非选择题,共10小题,共174分)
注意:
12.常温下,将一定量的H2SO4溶液与一定量的NaOH水溶液充分混合后,测得溶液的pH>7,则c(Na+)与c(SO2-4)的关系是 ( )
A.c(Na+)>c(SO2-4) B.c(Na+)=c(SO2-4)
C.c(Na+)>2c(SO2-4) D.c(Na+)<2c(SO2-4)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com