
10.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO原料为锌粒,电解液和空气。下列叙述正确的是
A.锌为正极,空气进入负极反应
B.正极反应为Zn-2e-=Zn2+
C.负极发生还原反应
D.电解液肯定不是强酸
9.关于如图所示装置的叙述,正确的是
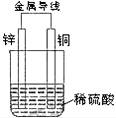
A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
8.当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是
A.AgI比AgCl稳定 B.氯的非金属性比碘强
C.I-的还原性比Cl-强 D.AgI的溶解度比AgCl小
7.室温时,0.01 mol·L-1某一元弱酸,则下列说法正确的是
A.上述弱酸溶液的pH=2
B.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
C.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7
D.加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH<7
6.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH = 7,则此溶液中
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定 c(HCOO-)与 c(Na+)的关系
5.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10∶1 B.5∶1 C.1∶1 D.1∶10
4.水的电离过程为H2O H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随着温度的升高而降低 B.在35℃时,c(H+)>c(OH-)
C.水的电离程度(25℃)>(35℃) D.水的电离是吸热的
3.将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
2.在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
1.下列说法正确的是
A.氧气不是电解质,所以是非电解质
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属弱电解质
D.纯净的强电解质在液态时,有的导电有的不导电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com