
4.用NA表示阿伏伽德罗常数,下列说法中正确的是 ( )
A.1mol甲烷中的氢原子被氯原子完全取代,需要Cl2的分子数目为2NA
B.0.5mol重水D2O中含有共价键为NA
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3NA
D.1mol·L-1Mg(NO3) 2溶液中含有NO3-的数目为2NA
3.下列叙述不正确的是 ( )
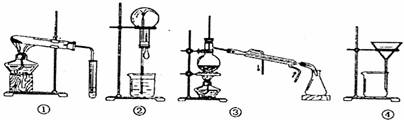
A.可用装置①鉴别碳酸钠和碳酸氢钠 B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水 D.可用装置④把胶体从溶液中分离出来
2.下列各组物质的分类正确的是 ( )
A.同位素:1H、D+、T2
B.电解质:H2O、CH3COOH、NH4HCO3
C.胶体:饱和氯化铁溶液、淀粉溶液、牛奶
D.硅酸盐产品:晶体硅、水泥、陶瓷
1.生产、生活离不开各种化学物质,下列说法不正确的是 ( )
A.二氧化硅是电子工业中常用的半导体材料
B.氢氧化铝可用于治疗胃酸过多
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.天然气、石油和煤均属于不可再生能源
22、(8分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
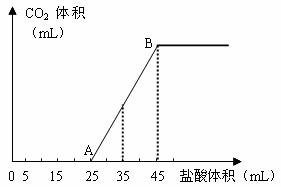
(1)写出OA段所发生反应的离子方程式 ,
__________________________ __。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
21、(10分)下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
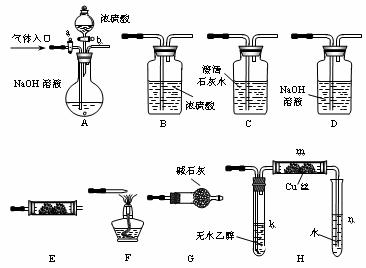
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________ (填代号)。能验证CO氧化产物的现象是___________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。m中反应的化学方程式为:
____________________________________________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因是: ______________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有___________性。
20、(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
则原溶液中肯定存在的离子是_____________,肯定不存在的离子是________________
已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
19、(16分)下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是常见金属单质、H为气体单质,D溶于水是一种常见的强酸,一个D分子含有18个电子,Y是一种淡黄色固体粉末。
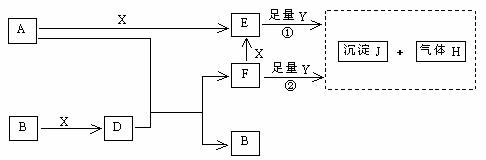
(1)写出化学式:B为_________,F为_________;
(2)写出D的电子式_________ ,液态D能否导电_________(填“能”或“否”);
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。A发生腐蚀的主要原因是(填写下面的选项序号)_________;
a.直接与氧气发生化学腐蚀 b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉
若你选定选项a或c,请写出相应的化学方程式;若你选定选项b,请写出负极的电极反应式:_______________________________ _____________________;
(4)①中所涉及的反应的化学方程式为:
__________________________________,______________________________ 。
18、(8分)根据下列事实完成下列反应方程式:
(1)AsH3是一种很强的还原剂。室温下,它能在空气中自燃,其氧化产物为As2O3,写出反应的化学方程式: 。
(2)白磷在一定条件下可被HClO3的水溶液氧化,生成磷的最高价态化合物,而氯元素被还原为最低价态,写出反应化学方程式 。
(3)稀硫酸与铜不反应,但在稀硫酸中加H2O2后,则可使铜顺利溶解,写出该反应的离子方程式: 。
(4)在火箭推进器中装有强还原剂(N2H4)和强氧化剂H2O2。当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量。写出此反应的热化学方程式:
。
17、(4分)请按要求填空:
下列实验操作或对实验事实的叙述正确的是__________________(填序号)
①用稀硝酸清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00mL 0.1000mol/L KMnO4溶液;
④用托盘天平称取10.50g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com