
9.化学与科技、社会、生活有着密切的联系,下列有关说法正确的是 ( )
A.2009年我国起征燃油税,工业上将石油蒸馏得到汽油,主要发生了化学变化
B.2008年诺贝尔化学奖授予研究绿色荧光蛋白的科学家,区分蛋白质溶液和葡萄糖溶液可利用丁达尔效应
C.2008年奶粉事件中污染物为三聚氰胺(结构如下图),其摩尔质量为126g
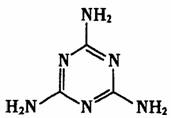
D.2008年支援四川灾区的生活用品中食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐
29.(178分) 已知芳香族化合物A、B、C、D的化学式均满足C8H8Ox,请按要求回答下列问题:
(1)A、B、C均为x=2的苯环上只有一个侧链的化合物,三者在碱性条件下可以发生如下反应:
A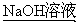
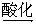 E(C7H6O2)+ F
E(C7H6O2)+ F
B 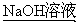
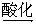 M(C6H6O)+ J
M(C6H6O)+ J
C 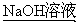
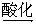 N(C7H8O)+ P
N(C7H8O)+ P
①写出C在NaOH溶液中应的化学方程式 。
反应类型为 。
②设计实验鉴别E、M、N(填写下列表格,步骤可不填满)
|
实验步骤 |
所用试剂 |
现象 |
结论 |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
(2)D为x=3的芳香族化合物,请写出两个只有两个对位取代基,且能发生银镜反应的有机物的结构简式 。
(3)当x=4时其中有一种化合物的结构简式为: 为实现以下物质的转化
为实现以下物质的转化
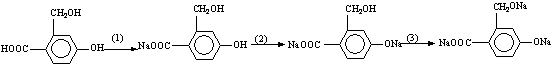 请用化学式填写下列空白处所需加入的适当试剂①
②
请用化学式填写下列空白处所需加入的适当试剂①
②
③ 。
28.(15分)某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装置及胶塞等略。
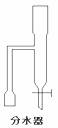
实验步骤如下:
I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:
①12.2g苯甲酸(其沸点为122℃,相对分子质量为122)和2粒沸石 ②8ml(足量)无水乙醇 ③适量的浓硫酸
II.如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
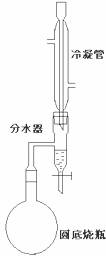
III.当不再有水生成,停止加热。
IV.冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
V.取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
根据以上操作过程回答以下问题:
(1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
(2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
(3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇
③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液
④有利于苯甲酸乙酯的水解
(4)写出该反应的化学方程式
(5)实验过程中,如果温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的无色稍有气味的气体,该气体的结构简式为
(6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是
①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出
②实验过程中,发生了副反应
③苯甲酸乙酯洗涤、蒸发过程中有损失
27.(18分) A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
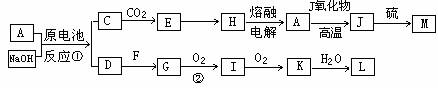
请回答以下问题:
(1)写出原电池的负极反应方程式______________________________________。
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者_______后者(用“>”、“<”或“=”表示)。
(3)金属A的氯化物沸点较低,又易升华,能否电解这种熔融氯化物来生产A?
__________。原因是_____________________________________________________。
(4)写出②的化学方程式____________________________________________________。
(5)写出A→J反应的化学方程式 。
(6)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色。
①水溶液与NaHCO3溶液混合,反应的离子方程式为________ ___。
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:
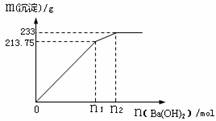
请回答:X晶体的俗名为__________;其溶液的物质的量浓度为_________mol/L。
26.(10分)五种短周期元素A、B、C、D、E,原子序数依次增大,C原子最外层电子数是A、B、D三种原子的最外层电子数之和, C可分别与A、B、D三种元素形成原子个数比为1:1的化合物甲、乙、丙,C与E是同族元素,B与E可形成原子个数比为1:2的化合物丁,E的最外层电子数是最内层电子数的3倍。请回答:
(1)具有相同电子数和原子数的分子互称为等电子体,写出由短周期元素组成的与乙互为等电子体的分子__________(用化学式表示)。
(2) B的氧化物分子中各原子最外层均为8电子结构的电子式为 。
(3)丙中所含的化学键类型为 。把一定量的丙固体分别加入下列物质的溶液中,不可能出现浑浊现象的是_________。
①饱和H2S溶液 ②Na2SO3稀溶液
③Ca(HCO3)2稀溶液 ④K2CO3稀溶液
(4)常温下丁是一种液体,加热到423K可与水反应生成两种酸性气体,写出此化学方程式。______________________________________________________
13.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)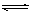 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是 ( )
A.若升高温度,X的体积分数增大,则正反应的△H>0
B.以X浓度变化表示的反应速率为0.001mol/(L·s)
C.若增大压强,则物质Y的转化率减小
D.若将容器体积变为20L,则Z的平衡浓度变为原来的1/2
第Ⅱ卷
本试卷共10小题,共174分。
12.下列说法中,不正确的是 ( )
A.弱酸HX溶液的pH=3,加水稀释100倍,3< pH <5
B.在0.1mol·L-1的CH3COOH中加入少量的CH3COONa固体,溶液中c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
11.用NA表示阿伏加德罗常数的数值,下列说法中一定正确的是 ( )
A.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA
B.4.8g 镁与足量盐酸反应时,转移0.2NA个电子
C.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
10.氯酸质量分数超过40%时会发生分解,反应可表示为:
8 HClO3 = 3 O2↑+ 2 Cl2↑+ 4 HClO4 + 2 H2O,下列说法正确的是 ( )
A.氧化性比较HClO4 > HClO3
B.氧化产物只有HClO4
|
D.该反应转移电子数为12e-
9.已知:H2(g)+F2(g)== 2HF(g);△H=-270 kJ/mol,下列说法正确的是 ( )
A.2 L HF气体分解成1 L的H2和1 L的F2吸收270 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.NA个H2分子与NA个F2分子反应生成2NA个HF分子吸收270 kJ热量在相同条件下
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com