
4.今有①HSO3-;②S2-;③SO32-;④HS-等四种溶液,向各种溶液中分别加入少量NaOH固体少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是 ( )
A.①④ B.只有① C.只有④ D.②③
3.下列反应的离子方程式正确的是:
A.用惰性电极电解氯化镁溶液:2C1-+2H2O C12↑+H2↑+2OH-
C12↑+H2↑+2OH-
B.铁和稀硝酸反应:Fe+2H+ Fe2++H2↑
C.C12通入溴化亚铁溶液中,当n(C12)=n(FeBr2)时:
2C12+2Fe2++2Br-===4C1-+2Fe3++Br2
D.少量CO2通入偏铝酸钠溶液中:CO2+A1O2-+2H2O Al(OH)3↓+HCO3-
2.三聚氰胺分子式为C3N6H6,结构简式为如下图,它被不法分子添加入婴幼儿奶粉中,是利用了它的 ( )
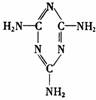
A.有效防止奶粉变质 B.增强蛋白质营养功能
C.具有很高含氮量 D.提高婴幼儿的消化和吸收效果
1.北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A.非金属单质燃烧时火焰均为无色
B.NaC1与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
28.(15分)碱式碳酸铜是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物。
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是 (填字母)。
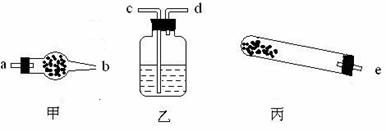
按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表。
|
仪器 |
试管 |
|
|
|
药品 |
碱式碳酸铜 |
|
|
还需使用的玻璃仪器是 。 。
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是 。
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是
。
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是 。
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等。现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是 (用含w、V的代数式表示)。
27.(15分)有关元素A、B、C、D的信息如下:
|
元素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
地壳中含量最高的元素,A与B可形成一种质量比为
7︰12的化合物(丙) |
|
C |
单质曾用于焊接钢轨 |
|
D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)用C单质来焊接钢轨的化学方程式是 。
(2)有关C与D元素,下列说法正确的是 (填序号)。
① C或D的高价盐均可用做净水剂
② 用C或D单质做成的槽车,都可用来运输甲的稀溶液
③ C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④ C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是 。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是 mL。
(5)已知:2AB2(g)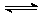 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
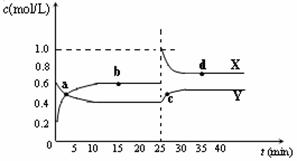
① a、b、c、d四个点中,化学反应处于平衡状态的是 点。
② 25 min时,增加了 (填物质的化学式) mol。
③ a、b、c、d四个点中所表示的反应体系中,气体颜色由深到浅的顺序是 (填字母)。
26.(15分)已知反应 ①、② 是化工生产中的两个重要反应:
① 甲溶液 A + B + C
A + B + C
② 乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是 。
(2)将A通入B的溶液中,反应的离子方程式是 。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是 。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是 。
(5)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是 。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
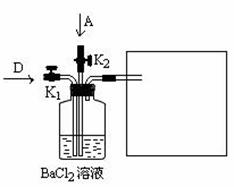
(6)一定条件下,将12 g乙放入过量的浓硝酸中,反应过程中转移1.5 mol电子,
该反应的离子方程式是 。
25.(15分) 已知,两种醛在碱性条件下有如下反应:
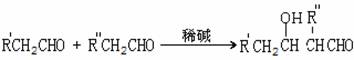 (-R′、-R″均为烃基)
(-R′、-R″均为烃基)
有机物D可由A、B制取:
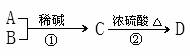
其中:
①有机物D是具有浓郁茉莉香型的芳香族化合物香料,分子式为C14H18O。
②经核磁共振氢谱(PMR)测定分析A中含有苯环、D中含有一个甲基。
③在一定条件下A可以和过量氢气进行加成反应,反应后的产物与B是同分异构体。
请回答:
(1)A的分子式是 。
(2)反应②的化学方程式是 ;反应类型是 。
(3)C分子中官能团的结构简式是 。
(4)C、D分别可以进行下列转化:
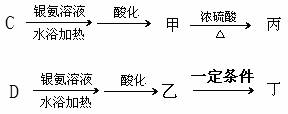
其中,丙是由一个甲分子形成的环状化合物,丁是一种高分子化合物。
丙的结构简式是 ;
乙→丁反应的化学方程式是 。
(5) 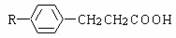 是C的一类同分异构体(-R为烃基),其中只 是-R含有两个甲基,其余部分均相同的同分异构体共有
种。
是C的一类同分异构体(-R为烃基),其中只 是-R含有两个甲基,其余部分均相同的同分异构体共有
种。
12.下列叙述正确的是 ( )
A.分别中和等体积、等pH的盐酸和醋酸,消耗的NaOH物质的量相同
B.常温下,等物质的量浓度的(NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小
C.NaHCO3溶液中离子浓度有如下关系:c(CO32-) + c (OH-) = c (H+) + c(H2CO3)
D.等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:
c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
第Ⅱ卷(非选择题,共180分)
本卷共11道题。
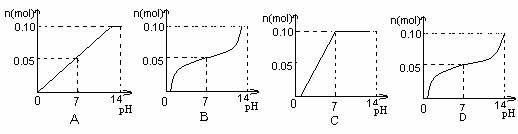
11.常温下,向盛有1L 0.1 mol/L NaHSO4溶液的烧杯中不断滴加0.05 mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况正确的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com