
13.实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸,调pH值为5;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。上述实验操作的正确顺序应是 ( )
A.①②⑤⑥⑦③④ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
第II卷
本卷共10题,共174分
12.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中正确的是 ( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中正确的是 ( )
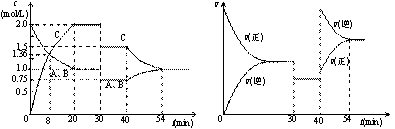
A.30min时降低温度,40min时升高温度
B.8min前C的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
11.下列划线部分物质在充分反应后能完全消耗的有 ( )
A.含少量CO2的1molCO气体与1mol Na2O2密封在容器中,不断电火花点燃
B.1mol MnO2与含4mol HCl的浓盐酸加热反应
C.1mol 无水C2H5OH与2mol冰醋酸在浓H2SO4作用下加热
D.少量淀粉酶加入含2g淀粉的溶液中,适当温度下反应足够长的时间
10.物质间某些方面存在相似性的同时还存在某些性质的递变性,下列说法正确的是( )
A.HClO4、H2SO4、H3PO4的酸性逐渐增强
B.等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多
C.CH3CH2OH、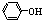 、CH3COOH电离出H+的能力由弱到强
、CH3COOH电离出H+的能力由弱到强
D.物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH由小到大
9.下列关于胶体的叙述不正确的 ( )
A.布郎运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.1L1 mol·L-1FeCl3完全水解生成胶体粒子数小于NA(设NA为阿伏加德罗常数)
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
8.K粉,医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性。因其物理形状通常为白色粉末,故称“K”粉。目前,该药物已被我国药检部门列为第二类精神药品管理。其结构简式如下。下列说法正确的是 ( )
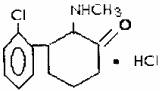
A.“K”粉的化学式为C13H10NOCl2
B.1mol“K”粉在一定条件下可与4molH2发生加成反应
C.“K”粉分子中至少有6个C原子处于同一平面
D.“K”粉不能与NaOH溶液发生反应
7.“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
24.(10分)对羟基苯甲醛是一种合成医药、香料、液晶材料的重要中间体,以对甲基苯酚
(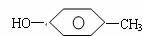 ) 为主要原料合成对羟基苯甲醛(
) 为主要原料合成对羟基苯甲醛(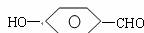 ) 的工艺流程如图所示。
) 的工艺流程如图所示。
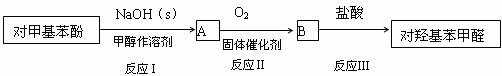
(1)写出反应Ⅱ化学方程式________________________________________ ,
B能跟银氨溶液反应生成银,写出该反应的化学方程式____________________
(2)在生产中不直接用氧气氧化对甲基苯酚的原因是_________________
(3)写出对羟基苯甲醛在一定条件下与足量氢气反应的化学方程式
___________________________________________________________
(4)对羟基苯甲醛有多种同分异构体,其中苯环上只有一个侧链的同分异构体的结构简式为______________________________________________.
23.(10分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个末成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、B两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺序为下列的__________(填序号)
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R >B单质
(2)CB3分子的空间构型是___________,其固体时的晶体类型为____________。
(3)写出D原子的核外电子排布式____________________,C的氢化物比D的氢化物在水中溶解度大的多的原因__________________________。
(4)D和Fe形成一种黄色晶体FeD2,FeD2晶体中阴、阳离子数之比为_____________,
FeD2物质中具有的化学键类型为______________________________。
[有机化学基础]
22.(12分)某固体混合物可能由Al 、(NH4)2SO4、MgCl2 、FeCl2 、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
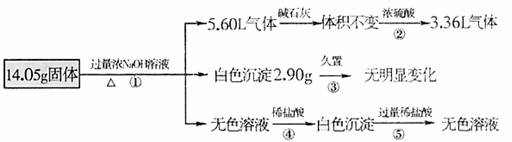
回答下列问题:
(1)写出反应④的离子方程式___________________________________________.
(2)填写下表中的空白。(注:若混合物中不存在该成分,则“质量”栏中填“0”;画斜线的表格不需填写)
|
成分 |
质量 |
判断依据或计算推理过程 |
|
Al |
|
|
|
(NH4)2SO4 |
|
|
|
MgCl2 |
|
|
|
FeCl2 |
|
|
|
AlCl3 |
|
|
选做题(10分)
说明:请考生从23、24两题中任选一题作答。若两题都做,则只批阅23题
[物质结构与性质]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com