
2.下列叙述正确的是 ( )
 A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应
1.2008年诺贝尔化学奖获得者之一钱永健在发现研究绿色莹光蛋白(GEP)如何发光等作出了突出贡献。下列对GFP等的叙述合理的是 ( )
A.GFP在硫酸铜或饱和硫酸铵溶液中发生盐析,盐析是可逆过程
B.GFP在酸、碱、酶作用下发生水解,水解的最终产物氨基酸只能与碱反应
C.GFP在乙醇等作用下会凝结、变性,变性为不可逆过程
D.GFP与水的液态混合物可用盐析法分离,盐析法为化学方法
27.(10分)
硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为 。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为_____。
(3)请在答题卡的框图中补充完成SiO2晶体的结构模型示意图(部分原子已画出),并进行必要标注。
(4)下表列有三种物质(晶体)的熔点:
|
物质 |
SiO2 |
SiCl4 |
SiF4 |
|
熔点/℃ |
1610 |
-69 |
-90 |
简要解释熔点差异的原因:
① SiO2和SiCl4:________________________________ ________________;
② SiCl4和SiF4:__________________________ _____________;
26.(10分)
在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行。
例如:
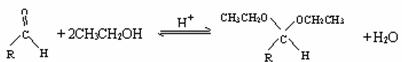
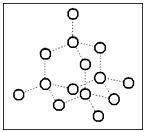
(1)1mol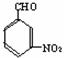 与2mol CH3OH 反应的产物除水外还有________(写结构简式)。
与2mol CH3OH 反应的产物除水外还有________(写结构简式)。
(2)欲使上述反应顺利向右进行,较合适的催化剂为 (填字母),理由是__________。
A.稀硫酸 B.稀盐酸 C.浓硫酸 D.酸性高锰酸钾溶液
(3)已知烯烃在一定条件下可以发生氧化,如:
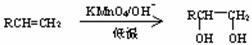
请设计合理方案由CH2=CH-CHO制备甘油醛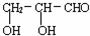 。
。
提示:合成反应流程图表示方法示例如下:
25.(9分)
一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
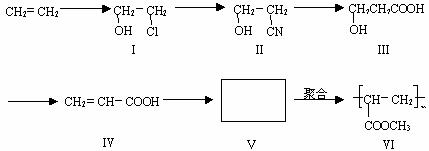
回答下列问题:
(1)目前工业上生产乙烯主要是以_________为原料通过__________反应来实现。
(2)化合物Ⅲ生成化合物Ⅳ的副产物为_____________。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物Ⅳ到化合物Ⅵ的两步反应方程式:(不要求标出反应条件)
_________________________________________________________________;
__________________________________________________________________。
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是 (填字母)。
A.化合物Ⅲ可以发生氧化反应
B.化合物Ⅲ不可以与NaOH 溶液反应
C.化合物Ⅳ能与氢气发生加成反应
D.化合物Ⅲ、Ⅳ和Ⅴ均可与金属钠反应生成氢气
E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
F.化合物Ⅴ可以发生水解反应
24.(12分)
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第_______周期_______族。
(2)铬元素以Cr2O72-离子的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+离子,
再用沉淀法进行分离。已知: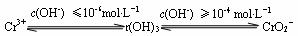
① FeSO4还原Cr2O72-的离子方程式为_____________________________。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为____________。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
A.K2Cr2O7是一种常用的强氧化剂
B.NaCrO2溶液与AlCl3溶液混合有沉淀生成
C.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
D.金属铬硬度大、耐腐蚀,是常用的镀层金属
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:

说明:1--用蒸馏水浸溶,2--用稀硫酸浸溶,3--冻融后用蒸馏水浸溶,4--曝晒后用蒸馏水浸溶;3%等--制砖时含铬废渣掺入的比例。
已知我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可)
_______________________________________________________________________;
_______________________________________________________________________。
23.(10分)
已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)  CO2(g)+H2(g)
CO2(g)+H2(g)
△H < 0 T1℃时,在容积为2.0L的密闭容器中充入2.0mol CO(g)和3.0mol H2O(g),保持温度不变,4 min后反应达到平衡,测得CO的转化率为60%。
(1)计算平衡时H2O的物质的量和T1℃时该反应的平衡常数。(写计算过程)
(2)请在答题卡的坐标图(如下)中,画出上述反应过程H2O、H2的物质的量随时间变化的图像(用实线)。假定将反应温度改为T2℃(T2 > T1,其它条件均不变),请在坐标图中再次画出H2O、H2的物质的量随时间变化的示意图(用虚线)。

22.(12分)
铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为__________________。从腐蚀废液回收得到金属铜还需要的试剂为________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是_____。(填字母)
|
选项 |
陈述I |
陈述II |
判断 |
|
A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
|
B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
|
C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
|
D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
(5)钢铁的析氢腐蚀简单示意图如下,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
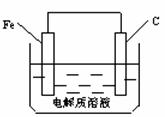
21.(10分)
某课题小组同学测量液态奶含氮量的实验过程如下:
原理: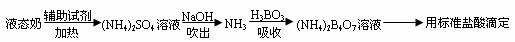
步骤:
① 在烧杯中加入10.00mL液态奶和辅助试剂,加热充分反应;
② 将反应液转移到大试管中;
③ 按如下装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
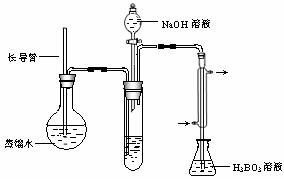
④ 取下锥形瓶,滴加指示剂,用0.1000 mol·L-1盐酸标准液滴定;
⑤ 重复测定两次,再用10.00mL蒸馏水代替液态奶进行上述操作。
数据记录如下:
|
实验编号 |
样品和辅助试剂 |
消耗盐酸体积(mL) |
|
1 |
10.00mL液态奶、0.2g催化剂、20mL浓硫酸 |
33.45 |
|
2 |
10.00mL液态奶、0.2g催化剂、20mL浓硫酸 |
33.55 |
|
3 |
10.00mL液态奶、0.2g催化剂、20mL浓硫酸 |
33.50 |
|
4 |
10.00mL蒸馏水、0.2g催化剂、20mL浓硫酸 |
1.50 |
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的化学方程式为______________。
(2)步骤③的实验装置中需要加热的仪器是_____________(填仪器名称),长导管的作用是_________________________________________________。
(3)设计4号空白对照实验的目的是______________________________________。
(4)计算10.00mL液态奶中的含氮量应代入计算的盐酸体积是 mL,该液态奶的含氮量为____________mg·mL-1。
20.(12分)
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
|
沉淀物 |
开始沉淀时的pH |
沉淀完全时的pH |
|
Mg(OH)2 |
9.6 |
11.1 |
|
Fe(OH)3 |
2.7 |
3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
|
实验操作 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
…… |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com