
11.根据图示判断下列叙述符合事实的是( )
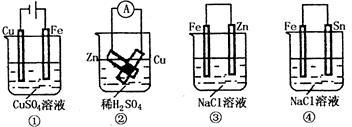
A.按图①连接并放置片刻后, 片会“镀”上一层铜
片会“镀”上一层铜
B.按图②连接好导线后( 片与
片与 片相接触),灵敏电流表会发生明显偏转
片相接触),灵敏电流表会发生明显偏转
C.按图③连接并放置片刻,在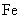 片附近加一滴
片附近加一滴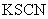 溶液,溶液变为红色
溶液,溶液变为红色
D.按图④连接并放置片刻,在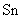 片附近加一滴酚酞试液,溶液变红色
片附近加一滴酚酞试液,溶液变红色
10.X、Y、Z、W四种主族元素均在短周期,且原子序数依次增大。已知X、Z两元素原子的最外层电子数均为其电子层数的2倍;Y、W的最外层电子数相同。下列说法中正确的是( )
A.X、Z两元素的氢化物分子中均含4对共用电子对
B.Y、Z、W均可分别与X形成非极性分子
C.Y的氢化物沸点比W的氢化物沸点低
D.Y的单质可与冷水反应并置换出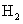
9.在一容积固定的真空密闭容器中,投入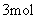
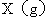 和
和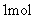
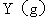 ,在一定温度下反应
,在一定温度下反应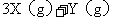
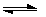
 达平衡,此时
达平衡,此时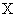 的转化率为
的转化率为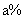 。若在同一温度同一容器中,最初投入的是
。若在同一温度同一容器中,最初投入的是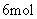
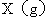 和
和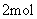
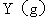 ,反应达平衡时
,反应达平衡时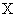 的转化率为
的转化率为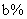 ,则下列判断正确的是( )
,则下列判断正确的是( )
A.若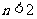 ,则
,则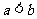 B.若
B.若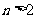 ,则
,则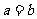
C.若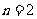 ,则
,则 D.若
D.若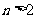 ,则
,则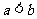
8.如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水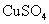 与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( )
与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( )
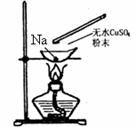
A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中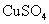 表现了还原性
表现了还原性
D.加热且无水条件下,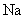 可以与
可以与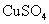 反应并生成
反应并生成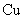
7.丙烯酰胺俗称“丙毒”,是一种强致癌物,存在于一些油炸食品中。丙烯酰胺的结构简式为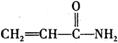 ,下列有关叙述中正确的是( )
,下列有关叙述中正确的是( )
A.丙烯酰胺与尿素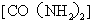 互为同系物
互为同系物
B.丙烯酰胺与丙氨酸互为同分异构体
C.丙烯酰胺可使酸性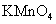 溶液褪色
溶液褪色
D.丙烯酰胺可以发生银镜反应
6.下列离子方程式书写不正确的是( )
A.把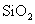 加入到
加入到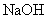 溶液中:
溶液中: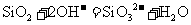
B.向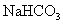 溶液中滴入
溶液中滴入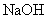 溶液:
溶液: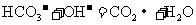
C.向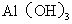 中滴入
中滴入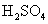 溶液:
溶液: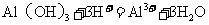
D.向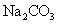 溶液中滴入
溶液中滴入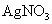 溶液:
溶液: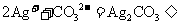
29.(15分)
已知两个羟基同时连在同一个碳原子上的结构是不稳定的,会自动脱水,如:
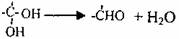
有机物M可在一定条件下发生下图所示的一系列变化。请回答下列问题:
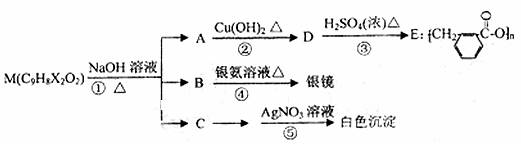
(1)元素X是 ,向C溶液中加入AgNO3溶液之前,应进行的操作是 。
(2)反应①~⑤中,属于氧化反应的是 。
(3)反应①中,1mol M最多可消耗 mol NaOH。
(4)写出结构简式:M ;B 。
(5)写出A→D反应的化学方程式: 。
28.(14分)已知:H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
某课外小组利用CO还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是一定浓度的硫酸,B中为H2C2O4固体。
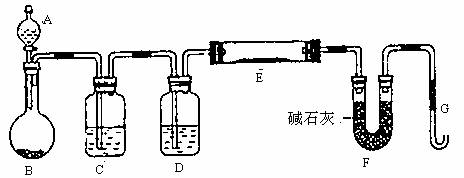
请问答下列问题。
(1)仪器中装入的试剂:C 、D ;
(2)连接好装置后应首先 ,其方法是
(3)“加热反应管E”和“从漏斗A中逐滴滴加液体”这两步操作应该首先进行的是 。在这两步之间还应进行的操作是 ;
(4)反应过程中G管逸出的气体是 ,其处理方法是 。
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的中质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)= ;计算式2:Ar(W)= 。
27.(15分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
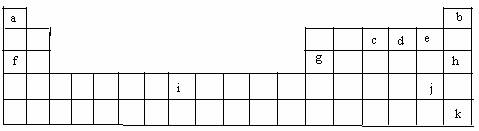
(1)i是铁元素,铁原子最外层有2个电子,请写出铁元素的原子结构示意图 ;
(2)以上元素形成的金属单质中:熔点最低的是 (填元素名称,下同);和盐酸或氢氧化钠溶液反应都能生成H2的是 ;
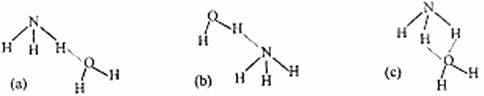
(3)NH3·H2O的电离方程式为:NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是下图中的(填字母)
;
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是下图中的(填字母)
;
(4)1886年化学家莫瓦桑用电解无水KHF2溶液的方法首先制备了F2,F2应在电解槽的
极生成;1962年,化学家巴特列首先制备出了某种稀有气体的氟化物,请预测这种稀有气体元素是 (填上表中的元素符号)。
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破。如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe,写出这一反应的化学方程式: 。
26.(16分)工业上用铂电极电解一定浓度的KHSO4溶液时,一个电极上放出H2气,另一个电极上可产生过二硫酸根离子(S2O82-),一段时间后会析出K2S2O8晶体。此晶体溶于水水解,可得到KHSO4和H2O2溶液,这是工业上制备H2O2的方法之一。请回答下列有关问题:
(1)在阳极,被氧化的元素名称是 ;在阴极,电极反应式是 ;理论上,当电路中转移0.1mol电子时,可得K2S2O 8 mol。
(2)K2S2O8水解的离子方程式是 。
(3)在下列反应中,H2 O 2只表现氧化性的是 ,H2O2只表现弱酸性的是 ,H2O2既表现氧化性又表现还原性的是 。
①PbS+4H2O2==PbSO4+4H2O
②NH3+H2O2==NH4OOH(或写成NH4HO2)
③2KMnO4+5H2O2+3H2SO4==2MnSO4+K2SO4+5O2↑+8H2O
④2KMnO4+9H2O2+3H2SO4==2MnSO4+ K2SO4+7O2↑+12H2O
(4)K2S2O8是一个很强的氧化剂。在某次钢样分析时,向酸溶后的浅绿色溶液(含FeSO4、MnSO4、H2SO4)中加入无色的K2S2O8时,溶液变为紫红色,此时的氧化产物为 和 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com