
11.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2 MnO2+H2O=ZnO+2MnO(OH)2下列说法正确的是 ( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0.1molZn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为:2MnO2+2e一+2H2O  2MnO(OH)+2OH-
2MnO(OH)+2OH-
10.下列说法正确的是 ( )
A.2008年诺贝尔化学奖授予在绿色荧光蛋白质的发现和研究方面做出贡献的科学家。绿色荧光蛋白质不能发生水解
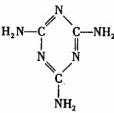
B.三聚氰胺俗称“蛋白精”,分子结构见下图,它是一种新的蛋白质
C.乙酸与乙醇在一定条件下发生酯化反应,加入浓H2SO4有利于酯化反应的进行
D.工业上,石油分馏可以得到乙烯,因此,世界上已将乙烯的产量作为衡量一个国家石油化工发展水平的标志
9.下列说法不正确的是 ( )
A.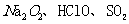 等物质都具有漂泊作用
等物质都具有漂泊作用
B.液氨、液氯、液态氯化氢都是电解质
C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化反应
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
31.(13分)[化学-有机化学基础]
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)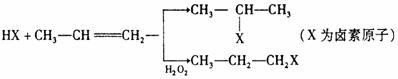
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。工业利用上述信息,按下列路线合成结构简式为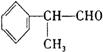 的物质,该物质是一种香料。
的物质,该物质是一种香料。
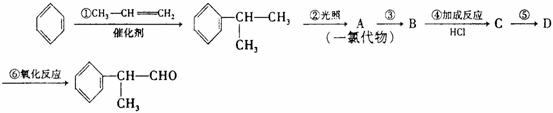
请根据上述路线,回答下列问题:
(1)A的结构简式可能为 。
(2)反应①、②、③的反应类型分别为 、 、 。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件): 。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只要写两种): 。
30.(13分)[化学-物质结构与性质]
氮及其化合物在生产、生活和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 。
(2)在氮气分子中,氮原子之间存在着 个σ键和 个π键
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”、“小于”或“等于”)
①氮原子的第一电离能 氧原子的第一电离能;
②N2分子中氮氮键的键长 白磷分子中磷磷键的键长;
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是 ;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为 。
25.(15分)用下图所示的Ⅰ和Ⅱ装置组合与Ⅰ和Ⅲ装置组合可以进行相关实验(夹持仪器省略),回答下列问题:
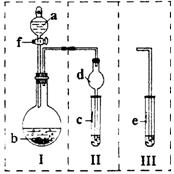
(1)若用Ⅰ和Ⅱ装置或Ⅰ和Ⅲ装置组合,实验前检查装置气密性的方法是 。
(2)在Ⅰ和Ⅱ装置组合中,若a为浓硫酸,b为铜粉,c容器中盛放品红溶液,旋开f后,给烧瓶加热,一段时间后c中的现象是 ,写出烧瓶中发生反应的化学方程式 。
(3)在Ⅰ装置中,若a为浓氨水,b为生石灰,欲制取氨气并证明氨水有碱性,最好应选用
(填“Ⅱ”或“Ⅲ”)装置与其组合,原因是 。
(4)在Ⅰ装置中,若a为可能含有Mg2+、Cu2+、Al3+、Fe3+四种阳离子的水溶液,b为过氧化钠固体,旋开f后,有白色沉淀产生并放出氧气,过氧化钠固体的物质的量与产生沉淀的质量关系如下图,则a溶液中含有的阳离子有 ,其阳离子的物质的量浓度之比为 。
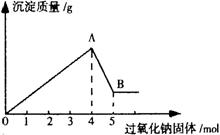
(5)在图中A→B段反应过程中溶液所增加的阴离子是 。
选考部分
第30、31题为化学题,考生从两道化学题中各任选一题作答,若第30、31题都作答,则按第30题计分;
24.(15分)甲醇是一种可再生燃料,可以利用天然气等物质生产,生产成本低,用途广泛。最近有科学家提出:把含有过量CO2的空气(通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。)吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想技术流程如下:
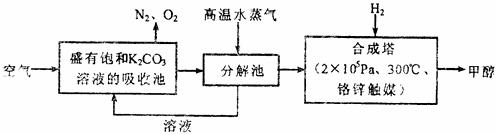
试回答下列问题:
(1)写出吸收池中主要反应的离子方程式 。
(2)写出分解池中反应的化学方程式 。
(3)在合成塔中,若有4.4 kg CO2与足量H2恰好完全反应,可放出4950 kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(4)甲醇的一个重要作用是可以制燃料电池,3%的甲醇水溶液在一种合金催化剂的作用下,在某一电极被氧化为CO2气体和H+;输送到另一电极室的空气或氧气,获得电子并与H+结合成水。该电池工作的总反应式为:2CH3OH+3O2=4H2O+2CO2,请写出两个电极上发生反应的电极方程式:正极 ,负极 。
23.(15分)四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是 。
(2)写出A和C化合生成CA3反应的平衡常数表达式 。在一定条件下要使该反应平衡向右移动,可采取的措施有 。
A.缩小反应容器容积 B.增大反应容器容积
C.使用合适的催化剂 D.及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因 ,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙: ;丙 。
12.X、Y、Z、W是含有同一元素的四种物质,其相互之间的转化关系为:
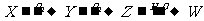 ,下列说法正确的是 (
)
,下列说法正确的是 (
)
A.该元素可以是氮元素或硫元素 B.Z→W的反应一定是氧化还原反应
C.W一定是酸 D.X只能是单质
第Ⅱ卷
必考部分
11.将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,下列叙述正确的是
( )
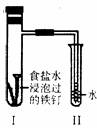
A.过一段时间,Ⅱ试管中的导管内水柱上升
B.Ⅰ试管中铁钉由于发生电解反应而被腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
D.Ⅰ试管中铁钉发生反应的一个电极反应式为:2Cl--2e-=Cl2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com