
(五) 问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C、D中反应完全,也不会得出正确的结论.经讨论,有的同学提出在B与C之间加入一个装置,该装置可以是 .再次实验后,得到了比较正确的结果.
21.(10分)
氢化阿托醛( 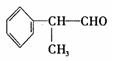 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下:
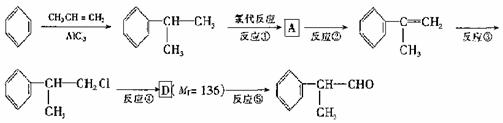
(1)在合成路线上①-⑤反应中,属于消去反应的为 (填反应序号).
(2)写出反应④的化学方程式: .
(3)在一定条件下, D与有机物X发生酯化反应生成E(Mr=164),则X的结构简式为 ,写出满足下述两条件E的两种同分异构体的结构简式:a.属于羧酸; b.苯环上的一氯取代物只有一种结构 .
22.(9分)将3.2 g Cu溶于30 mL R
mol/L过量硝酸溶液中,已知硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1.0 L,测得c(NO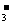 )=0.20 mol/L.
)=0.20 mol/L.
(1)求稀释后溶液的pH.
(2)求生成的气体中NO2和NO的物质的量(用含有R的代数式表示).
(3)用NaOH溶液吸收氮的氧化物以防止污染,原理是:
NO + NO2 + NaOH = 2NaNO2 + H2O,
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
若生成的混合气体能被NaOH溶液完全吸收,试讨论R的取值范围.
(四) 计算:
样品中铜的质量分数 = _____________________(用含W、m1、m2的代数式表示).
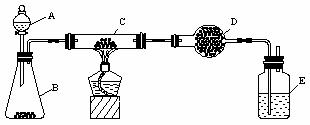
(三) 实验内容:
|
实验步骤 |
实验现象 |
有关化学方程式 |
|
检查气密性. 在C中加入样品粉末W g,D中装入药品后并称重为m1 g. |
|
|
|
打开A的活塞,慢慢滴加溶液. |
|
|
|
对C进行加热. 当C中药品充分反应后,关闭A的活塞,停止加热. |
|
|
|
冷却后,称量D的质量为m2 g |
|
|
(二) 实验用品:
仪 器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等;
药 品:红褐色铜粉(含少量炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等.
(一) 实验目的:测定铜粉样品中铜的质量分数.
1.下列说法正确的是 ( )
A.三聚氰胺(C3H6N6)含氮量高,牛奶中加入它可以增加蛋白质的含量
B.硫磺蒸熏过的馒头变得更白,这有利于人体健康
C.过氧乙酸(CH3COOOH)具有强氧化性,可用于杀菌消毒
D.福尔马林是一种良好的杀菌剂,可用于消毒饮用水
2.下列化合物不能通过化合反应获得的是 ( )
A.Na2O2 B.FeS C.CuS D.Fe(OH)3
3.下列关于工业生产说法中,错误的是 ( )
A.工业上采用电解熔融氯化铝的方法制取金属铝
B.在氯碱工业中,电解槽被离子交换膜隔成阴极室和阳极室
C.在合成氨工业中,采用循环操作提高原料利用率
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
4.观察下列模型并结合有关信息进行判断,下列说法错误的是 ( )
|
|
HCN |
S8 |
SF6 |
B12结构单元 |
|
结构模型 示意图 |
 |
 |
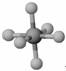 |
 |
|
备注 |
/ |
易溶于CS2 |
/ |
熔点1873K |
A.HCN的结构式为H-C≡N
B.固态硫S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属原子晶体,结构单元中含有30个B-B键,含20个正三角形
5.下列各组离子在指定溶液中能大量共存的是 ( )
A.无色溶液中:K+、Cu2+、Na+、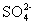
B.强酸性溶液中:Al3+、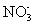 、I-、Cl-
、I-、Cl-
C.pH=11的溶液中:Na+、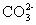 、
、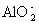 、
、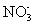
D.加入Al能放出H2的溶液中: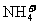 、Cl-、
、Cl-、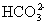 、
、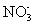
6.下列反应的离子方程式错误的是 ( )
A.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3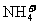
B.向苯酚钠溶液中通入CO2: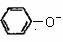 +CO2+H2O
→
+CO2+H2O
→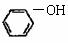 +
+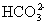
C.小苏打溶液中加入少量石灰水:2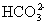 +Ca2++2OH-=CaCO3↓+
+Ca2++2OH-=CaCO3↓+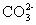 +2H2O
+2H2O
D.NaHS水解反应:HS-+H2O S2-+H3O+
S2-+H3O+
7.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是 ( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊,再升温至65℃以上,又变澄清. |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊,继续通CO2至过量,又变澄清. |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊,再加入少量品红溶液,红色褪去. |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊,继续通CO2至过量,又变澄清.再加入足量NaOH溶液,又变浑浊. |
Ca(OH)2溶液 |
8.NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.2.8 g乙烯和丙烯的混合物中所含碳原子数为0.2NA
B.4.48 L H2和O2的混合物中所含分子数为0.2NA
C.4 g重水(D2O)中所含质子数为0.2NA
D.200 mL 1 mol/L的氨水中含NH3·H2O分子数为0.2NA
9.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是 ( )
A.10% B.25% C.30% D.35%
10.常温下,0.1 mol/L KCl溶液和0.1 mol/L CH3COOK溶液各100 mL,两溶液中所含离子总数 ( )
A.一样多 B.KCl溶液中多 C.CH3COOK溶液中多 D.无法比较
11.下列实验基本操作正确的是 ( )
A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
B.将氢氧化钠固体放在纸片上称量
C.测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量
D.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH
12.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+Y(g)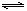 2Z(g);△H<0.当改变某一条件并达到新平衡后,下列叙述正确的是 ( )
2Z(g);△H<0.当改变某一条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的转化率增大
B.缩小容器体积,Z的浓度不变
C.保持压强不变,再充入0.1 mol X和0.1 mol Y,X的体积分数增大
D.保持容器体积不变,充入一定量的氦气,Y的浓度不变
13.强氧化剂PbO2在酸性溶液中可将Mn2+氧化成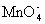 .取一支试管,加入适量PbO2固体和2 mL 6 mol/L H2SO4,然后滴入2
mL 1 mol/L MnSO4溶液.下列说法错误的是( )
.取一支试管,加入适量PbO2固体和2 mL 6 mol/L H2SO4,然后滴入2
mL 1 mol/L MnSO4溶液.下列说法错误的是( )
A.充分振荡后静置,溶液颜色变为紫色
B.若上述实验完全反应,消耗PbO2的物质的量为0.01 mol
C.上述实验不能用盐酸代替硫酸
D.在酸性条件下,PbO2的氧化性比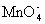 的氧化性强
的氧化性强
14.取pH均等于1的盐酸和醋酸各200 mL,分别稀释2倍,再分别加入0.6 g锌粉,在相同的条件下充分反应.有关叙述正确的是 ( )
A.放出氢气一样多 B.醋酸与锌反应放出氢气多
C.反应速率一样快 D.盐酸与锌反应速率快
15.按下图所示装置进行实验(其中C1、C2均是石墨电极),下列说法中错误的是( )
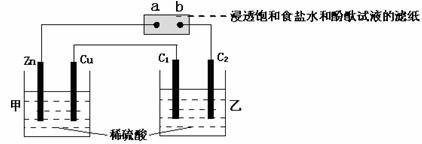
A.在标准状况下,Zn极减轻3.25 g时,Cu极上放出气体体积约为1.12 L
B.发现a点附近显红色
C.在C1、C2电极所产生气体的体积比为2∶1
D.乙池溶液的pH减小
16.向含有1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol/LBa(OH)2溶液。下列图象能正确表示产生沉淀的物质的量(n)与加入溶液的体积(V)之间关系的是 ( )
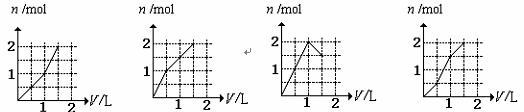
A B C D
第Ⅱ卷(非选择题 60分)
17.(8分)常温下,向20 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示:
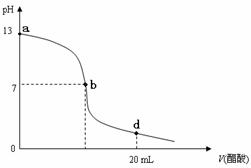
(1)该氢氧化钠溶液的物质的量浓度为 .
(2)在b点,c(Na+) c(CH3COO-)(填“>”、“<”或“=”) .
(3)氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线的 (填选项的编号).
A.a点 B.b点 C.d点 D.a、b间的某点 E.b、d间的某点
(4)在d点,溶液中所有离子浓度由大到小的顺序为: .
18.(10分)甲、乙、丙、丁、戊是五种短周期元素,其原子序数依次增大,它们可以组成下列框图所有物质.甲与乙、丙与乙均可形成原子个数比为2∶1和1∶1的化合物,丁元素原子的最外层电子数是其电子层数的2倍,框图中溶液M为黄绿色.在一定条件下,下列各物质可发生如图所示的变化.试回答:
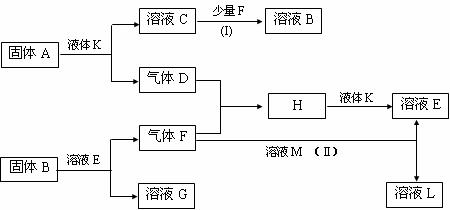
(1)戊元素的原子结构示意图为 .
(2)A的电子式为 .
(3)工业上由F制备H的条件是 .
(4)反应(I)的离子方程式为 .
(5)反应(II)的化学方程式为 .
19.(12分)在酸性条件下,次氯酸钠、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.
Mg(OH)2和Fe(OH)2在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2(含有FeCl2、FeCl3、MnCl2等杂质).若以它为原料,按下图工艺流程可制得“轻质氧化镁”.要求产品不含杂质离子,而且成本较低,流程中溶液pH调节和所用试剂可参考表1、表2来确定.
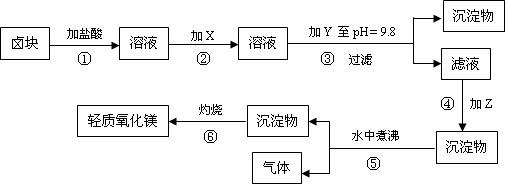
表1:
|
物质 |
开始沉淀pH |
沉淀完全pH |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH)2 |
9.6 |
11.1 |
表2:
|
工业品 |
规格 |
价格 (元/吨) |
|
漂液 |
含NaClO 25.5% |
450 |
|
过氧化氢溶液 |
含H2O2 30% |
240 |
|
烧碱 |
含NaOH 98% |
2100 |
|
纯碱 |
含Na2CO3 99.5% |
600 |
|
卤块 |
含MgCl2 30% |
310 |
请填下列空白:
(1)在步骤②中加入物质X,最佳的选择应是 ,
理由是 ;
步骤②中反应的离子方程式为 .
(2)在步骤③中要控制pH=9.8,其目的是 .
(3)在步骤④中加入物质应是 .
(4)在步骤⑤中发生的化学方程式为 .
20.(11分)某课外活动小组用下图装置对铜粉(含少量炭)样品进行实验.图中铁架台等装置已略去.请完成下列实验报告.
29.(15分)有机物A是一种含溴的酯,分子式为C6H9O2Br。已知A有如下的转化关系:
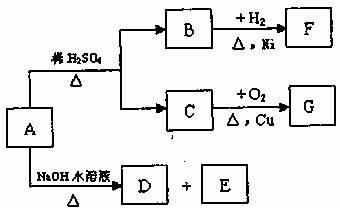
其中B、C含相同数目的碳原子,B既能使溴水褪色,又能与Na2CO3溶液反应放出CO2气体,G能发生银镜反应,经测定E是一种二元醇,且E分子中含有一个甲基。
(1)写出D的结构简式 。
(2)写出B中官能团的名称 。
(3)写出C催化氧化的化学方程式: 。
(4)写出F属于酯类的同分异构体的结构简式
; 。
(5)写出A在NaOH水溶液中水解的化学方程式: 。
28.(13分)
I.下列实验操作不能达到实验目的的是 。
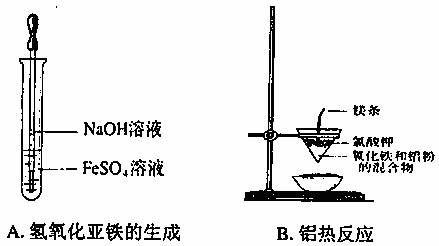
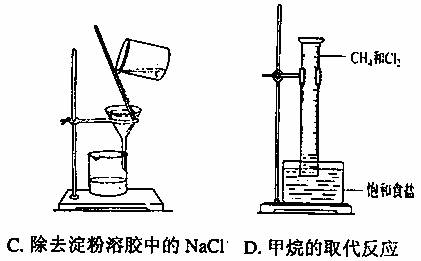
II.有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO32-、I-、CO32-、Cl-、SO42-、Fe2+、Na+,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B。
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C。
步骤三:往C中加入足量氯水,得黄色溶液D。
(1)该溶液中一定存在的阴离子是 。
(2)该溶液中可能存在的阴离子是 。
(3)步骤三中溶液变黄可能是因为生成了 (填化学式);确认其存在的实验操作与现象是:取适量D溶液于试管中,
27.(17分)
(1)下图是H2(g)和Cl2(g)反应的能量变化示意图
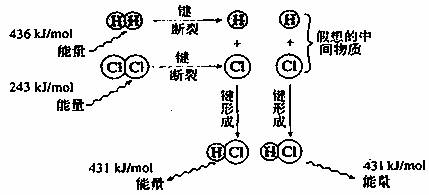
写出H2(g)和Cl2(g)反应的热化学方程式: 。
(2)恒温恒容下,判断合成氨反应达到平衡的标志有 。
A.v正(N2)=3v逆(H2)
B.气体的压强不再随时间变化
C.气体的密度不再随时间变化
D.各组分的浓度相同
E.气体的平均相对分子质量不再随时间变化
(3)以NH3和Fe2O3为主要原料,选择合适的其它原料,制备Fe(NO3)3。写出有关反应的化学方程式:
(4)实验室常用生石灰和浓氨水快速制取NH3,阐述反应原理。
26.(15分)有A、B、C、D、E五种短周期元素,其原子序数依次增大。已知:
(1)D原子核中的质子数比A多10个。E的单质可与D的最高价氧化物的水化物反应生成A的单质。
(2)A、B组成的化合物x可用作制冷剂。X分子为三角锥型,且一个X分子中含10个电子。
(3)A、C组成的化合物Y是一种无色黏稠液体。一个Y分子中含18个电子,其分子中A、C元素的原子个数比为1:1。
根据上述信息回答下列问题:
(1)B元素在同期表中的位置是 。
(2)请画出A-的结构示意图 。
(3)请写出化合物Y的电子式 。
(4)D与C可形成一种淡黄色固体F,请用化学方程式表示出F的一种用途
。
(5)E的单质与D的最高价氧化物的水化物反应生成A的单质,写出所有符合此反应条件的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com